
 .从分液漏斗上口倒出的上层液体是苯.
.从分液漏斗上口倒出的上层液体是苯. 分析 苯酚和与氢氧化钠溶液反应生成易溶于水的苯酚钠,而苯不溶于水,则在分液漏斗中溶液分层,在溶液中加入盐酸生成苯酚,加入氯化铁可发生显色反应,加入浓溴水,苯酚与溴发生取代反应生成三溴苯酚,以此解答.
解答 解:苯酚具有酸性能和氢氧化钠反应生成可溶性的苯酚钠,反应的离子方程式:C6H5OH+OH-→C6H5O-+H2O,而苯不溶于水,则在分液漏斗中溶液分层,在溶液中加入盐酸生成苯酚,加入氯化铁可发生显色反应,溶液变成紫色,加入浓溴水,苯酚与溴发生取代反应生成三溴苯酚,反应的方程式为 ,苯的密度比水小,从分液漏斗上口倒出的上层液体是苯,
,苯的密度比水小,从分液漏斗上口倒出的上层液体是苯,
故答案为:C6H5OH+OH-→C6H5O-+H2O;溶液变成紫色; ;苯.
;苯.
点评 本题考查了苯酚的性质,侧重于学生的分析能力和实验能力的考查,为高频考点,难度不大,注意苯酚与溴水、氢氧化钠反应的性质,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 原子核外电子排布决定了该原子的化学性质 | |
| B. | 根据原子序数可以推知该原子的中子数和其在周期表中的位置 | |
| C. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca是具有相同质量数的同位素原子 | |
| D. | 所有的原子核都是由质子和中子组成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 增大反应体系的压强,反应速率一定增大 | |
| C. | 一段时间内生成1 mol O2(g)同时生成1 mol SO3(g),说明反应达到平衡 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
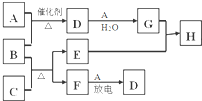 下图涉及的物质所含元素中,除一种元素外,其余均为短周期元素.已知:A、F为无色气体单质,B为能使湿润红色石蕊试纸变蓝的气体,C为黑色氧化物,E为红色金属单质,H为蓝色溶液(部分反应的产物未列出).请回答下列问题:
下图涉及的物质所含元素中,除一种元素外,其余均为短周期元素.已知:A、F为无色气体单质,B为能使湿润红色石蕊试纸变蓝的气体,C为黑色氧化物,E为红色金属单质,H为蓝色溶液(部分反应的产物未列出).请回答下列问题: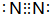 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚、乙醇、苯、四氯化碳 | B. | 乙烯、乙烷、乙炔、丙烯 | ||
| C. | 甲酸、乙醛、甲酸钠溶液、乙酸乙酯 | D. | 苯乙烯、苯酚、乙苯、甲苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
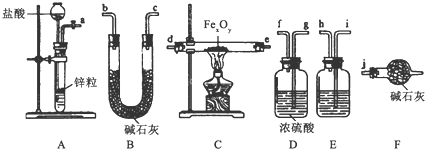
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
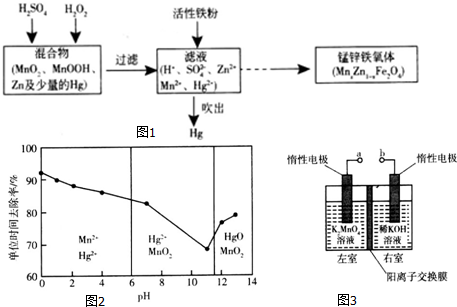
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | XYZ2 | B. | XYZ3 | C. | X2YZ2 | D. | X3YZ3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:2:1 | B. | 2:1:1 | C. | 2:1:2 | D. | 2:2:5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com