
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生,下列属于未来新能源标准的是:①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A. ⑤⑥⑦ B. ⑤⑥⑦⑧ C. ③⑤⑥⑦⑧ D. ③④⑤⑥⑦⑧
 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案科目:高中化学 来源: 题型:
【题目】由于Fe(OH)2极易被氧化,所以实验室难用亚铁盐溶液与烧碱反应制得白色纯净的Fe(OH)2沉淀.若用如图所示实验装置可制得纯净的Fe(OH)2沉淀.两极材料分别为石墨和铁.

(1)a电极材料为_____.其电极反应式为_____.
(2)电解液d可以是_____,则白色沉淀在电极上生成;也可以是_____,则白色沉淀在两极之间的溶液中生成.
A.纯水 B.NaCl溶液 C.NaOH溶液 D.CuCl2溶液
(3)液体c为苯,其作用是_____,在加入苯之前,对d溶液进行加热处理的目的是____.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5 mol H2O的质量为 ____,其中含有_____个水分子,共有____个原子。
(2)质量都是50 g的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是______,在相同温度和相同压强条件下,体积最大的是______,体积最小的是________。
(3)在_______mL 0.2 mol/L NaOH溶液中含1 g溶质;配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O _________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.10mol/L、体积均为V0的HA和HB溶液,分别加水稀释至体积V,pH随![]() 的变化如图所示,下列叙述正确的是
的变化如图所示,下列叙述正确的是
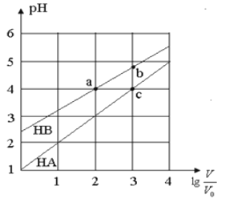
A.该温度下HB的电离平衡常数约等于1.11×10-5
B.相同条件下NaA溶液的pH大于NaB溶液的pH
C.溶液中水的电离程度:a=c>b
D.当![]() =3时,若两溶液同时升高温度,则
=3时,若两溶液同时升高温度,则![]() 减小
减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活、社会密切相关。 下列叙述错误的是( )
A.还原铁粉能用作食品抗氧化剂
B.“日照遂州江雾开”中伴有丁达尔效应
C.浸泡过KMnO4溶液的硅土可作水果保鲜剂
D.河水中有许多杂质和有害细菌,加入明矾消毒杀菌后可以饮用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。下列说法不正确的是

A.O2在电极b上发生还原反应
B.溶液中OH—向电极a移动
C.反应消耗的NH3与O2的物质的量之比为4:5
D.负极的电极反应式为:2NH3-6e—+6OH—=N2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学反应原理回答下列问题:
(1)在一定条件下,将1.00molN2(g)与3.00molH2(g)混合于一个10.0L密闭容器中,在不同温度下达到平衡时NH3(g)的平衡浓度如图所示.其中温度为T1时平衡混合气体中氨气的体积分数为25.0%.

①该反应的焓变△H__0.(填“>”或“<”)
②该反应在T1温度下5.00min达到平衡,这段时间内N2的化学反应速率为______.
③T1温度下该反应的化学平衡常数K1=______.
(2)科学家采用质子高导电性的SCY陶瓷(可传递H+)实现了低温常压下高转化率的电化学合成氨,其实验原理示意图如图所示,则阴极的电极反应式是____________.

(3)已知某些弱电解质在水中的电离平衡常数(25℃)如表:
弱电解质 | H2CO3 | NH3H2O |
电离平衡常数 | Ka1=4.30×10﹣7 Ka2=5.61×10﹣11 | Kb=1.77×10﹣5 |
现有常温下0.1molL﹣1的(NH4)2CO3溶液,
①该溶液呈__性(填“酸”、“中”、“碱”),原因是___________.
②该(NH4)2CO3溶液中各微粒浓度之间的关系式不正确的是__.
A.c(NH4+)>c(CO32﹣)>c(HCO3﹣)>c(NH3H2O)
B.c(NH4+)+c(H+)=c(HCO3﹣)+c(OH﹣)+c(CO32﹣)
C.c(CO32﹣)+c(HCO3﹣)+c(H2CO3)=0.1mol/L
D.c(NH4+)+c(NH3H2O)=2c(CO32﹣)+2c(HCO3﹣)+2c(H2CO3)
E.c(H+)+c(HCO3﹣)+c(H2CO3)=c(OH﹣)+c(NH3H2O)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g) △H=-746.8kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是
2CO2(g)+N2(g) △H=-746.8kJ·mol-1,可净化汽车尾气,如果要同时提高该反应的速率和NO的转化率,采取的措施是
A. 降低温度 B. 缩小体积使压强增大
C. 升高温度同时充入N2 D. 及时将CO2和N2从反应体系中移走
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,硝酸越稀,还原产物中氮元素的化合价越低。某同学取适量的铁铝合金与足量很稀的硝酸充分反应,没有气体放出。在反应结束后的溶液中,逐滴加入4 molL-1的NaOH 溶液,所加NaOH溶液体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示。下列说法不正确的是

A. OC段离子反应方程式:H++OH-==H2O
B. 溶液中 n(NH4+) =0.012 mol
C. 溶液中结合OH-能力最强的离子是H+,最弱的离子是Al3+
D. 欲测定F点沉淀的质量,实验步骤是过滤、洗涤、干燥、称量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com