
钛及其合金具有密度小、强度高、耐酸、碱腐蚀等优良性能,被广泛用于航天、航空、航海、石油、化工、医药等部门。由钒钛磁铁矿经“选矿”得到的钛铁矿提取金属钛(海绵钛)的主要工艺过程如下:

(1)钛铁矿的主要成分为FeTiO3。控制电炉熔炼温度(<1500K),用等物质的量的碳还原出铁,而钛以二氧化钛的形式进入炉渣浮于熔融铁之上,使钛与铁分离,钛被富集。写出相关反应:
(2)已知氯化反应过程中会产生一种无色可燃性气体,请写出在1073—1273K下氯化反应的化学方程式:
(3)氯化得到的TiCl4中含有的VOCl3必须用高效精馏的方法除去。实际生产中常在409 K下用Cu还原VOCl3,反应物的物质的量之比为1:1,生成氯化亚铜和难溶于TiCl4的还原物,写出此反应方程式:
(4)TiCl4的还原通常在800oC的条件下进行,反应过程中通入氩气的目的是 ,试写出从还原产物中分离出海绵钛的步骤
(5)电解法冶炼钛的一种生产工艺是将TiO2与 粉末与黏结剂混合后,压制成电解阴极板,用石墨作阳极,熔融氧化钙作电解质,电解过程中阳极生成O2和CO2气体,破碎洗涤阴极板即得到电解钛。试写出阴极反应方程式 。
粉末与黏结剂混合后,压制成电解阴极板,用石墨作阳极,熔融氧化钙作电解质,电解过程中阳极生成O2和CO2气体,破碎洗涤阴极板即得到电解钛。试写出阴极反应方程式 。
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南大学出版社系列答案
同步练习西南大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案科目:高中化学 来源:2015-2016学年浙江省宁波市高二下学期期中考试化学试卷(解析版) 题型:选择题
A. 提纯混有少量硝酸钾的氯化钠,应采用在较高温度下制得浓溶液再蒸发浓缩、冷却结晶、过滤、洗涤、干燥的方法
B. 纸层析法通常把不与水混溶的有机溶剂作为流动相
C. 洗涤沉淀时应开大水龙头,增加洗涤剂过滤速度,带走杂质
D. 减压过滤装置中,布氏漏斗的颈口斜面应与吸滤瓶的支管口相背,以防止滤液被吸出抽滤瓶外
查看答案和解析>>
科目:高中化学 来源:2015-2016学年江西省高一下学期期中考试化学试卷(解析版) 题型:选择题
下列变化属于放热反应的是( )
①碳与二氧化碳化合
②生石灰与水反应生成熟石灰
③Zn与稀硫酸反应
④浓硫酸溶于水
⑤Ba(OH)2.8H2O与NH4Cl反应
⑥甲烷与氧气的燃烧
A.①②④⑥ B.①④⑤ C.②③⑥ D.②④⑥
查看答案和解析>>
科目:高中化学 来源:2016届云南省高三下第七次月考理综化学试卷(解析版) 题型:填空题
NO2、CO、CO2是对环境影响较大的气体,对它们的合理控制、利用是优化我们生存环境的有效途径。
(1)如图所示,利用电化学原理将NO2 转化为重要化工原料C。

若A为NO2,B为O2,则负极的电极反应式为______________________________;
(2)有一种用CO2生产甲醇燃料的方法:
CO2+3H2 CH3OH+H2O
CH3OH+H2O
已知:
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
CH3OH(g)+H2O(g) △H=-a kJ·mol-1;
2H2(g)+O2(g)=2H2O(g) △H=-b kJ·mol-1;
H2O(g)=H2O(l) △H=-c kJ·mol-1;
CH3OH(g)=CH3OH(l) △H=-d kJ·mol-1,
则表示CH3OH(l)燃烧热的热化学方程式为:_________________________________;
(3)光气 (COCl2)是一种重要的化工原料,用于农药、医药、聚酯类材料的生产,工业上通过Cl2(g)+CO(g)  COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
COCl2(g)制备。左图为此反应的反应速率随温度变化的曲线,右图为某次模拟实验研究过程中容器内各物质的浓度随时间变化的曲线。回答下列问题:
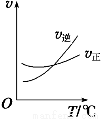

①0~6 min内,反应的平均速率v(Cl2)= ;
②若保持温度不变,在第7min 向体系中加入这三种物质各2mol,则平衡向____________________
移动(填“向正反应方向”、“向逆反应方向”或“不”);
③若将初始投料浓度变为c(Cl2)=0.7mol/L、c(CO)=0.5mol/L、c(COCl2)_________ mol/L,保持反应温度不变,则最终达到化学平衡时,Cl2的体积分数与上述第6min时Cl2的体积分数相同;
④随温度升高,该反应平衡常数变化的趋势是__________;(填“增大”、“减小”或“不变”)
⑤比较第8min反应温度T(8)与第15min反应温度T(15)的高低:T(8)_______T(15)(填“<”、“>”或“=”)
查看答案和解析>>
科目:高中化学 来源:2016届辽宁师大附中高三下学期精品考试理综化学试卷(解析版) 题型:选择题
下列叙述正确的选项是
A.对于一定条件下的某一可逆反应,用平衡浓度表示的平衡常数和用平衡分压表示的平衡常数,其数值不同,但意义相同,都随温度的升高而增大。
B.结构式为 的物质互为同分异构体
的物质互为同分异构体
C.根据反应:NaA+CO2(少量)+ H2O==HA+NaHCO3 ; 2NaB+CO2+H2O== 2HB+Na2CO3,可以得出酸的强弱的顺序为:H2CO3 > HA> HCO3 — > HB
D.过硼酸钠晶体(NaBO3·4H2O)是一种优良的漂白剂,在70℃以上加热该晶体30.80克,反应后称量固体质量为27.20克,则该固体物质的化学式为NaBO3.H2O。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三考前热身(五模)化学试卷(解析版) 题型:简答题
氧化锌吸收法常用作脱去冶金工业排放烟气中SO2,其主要步骤如下:配制ZnO悬浊液(含少量MgO、CaO),在吸收塔中封闭循环脱硫,发生的主要反应为ZnO(s)+SO2(g)=ZnSO3(s),
试回答下列问题:
(1)氧化锌吸收SO2的需控制合适的吸收温度的原因是_____________________;
(2)生成的ZnSO3可热分解处理,其目的是:①生成的高浓度SO2可以用来制备硫酸;②___________;
(3)已知:纯ZnO的悬浮液pH约为6.8.用氧化锌吸收法脱去烟气中SO2的过程中,测得pH随时间t的变化如图1所示。已知被吸收的SO2为c(SO2)吸,溶液中SO32-、HSO3-、H2SO3所占物质的量之比与pH的关系如图2所示。
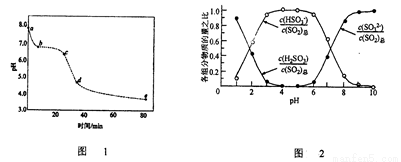
①充分吸收烟气后的混合体系硫元素的主要存在形式是__________________;
②结合图1与图2分析,cd段发生的主要反应是__________________;
③分析图1,ab段的pH迅速下降至6.8左右的原因是______________________;吸收30分钟后吸收效率下降的原因是_____________________;
(4)如用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH,同时得到H2SO4,其原理如下图所示。(电极材料为石墨)
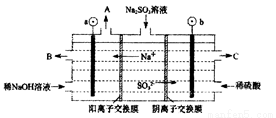
b极的电极反应式为_______________________________________。
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三考前热身(五模)化学试卷(解析版) 题型:选择题
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
B.10mol·L-1的浓氨水:Al3+、NH4+、NO3-、I-
C.与Al反应放出H2的溶液:Mg2+、Ca2+、NO3-、HCO3-
D.c(H+)/c(OH-)=1×10-12的溶液:K+、AlO2-、CO32-、Na+
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com