
| A. | KCl | B. | NaF | C. | Na2O | D. | NaCl |
分析 Y元素的最高正价与负价的代数和为6,最高正价和最低负价的绝对值的代数和为8,由此计算Y元素最高价+7,最低负价-1,Y是第ⅦA族的元素,结合Y离子和M离子相同的电子层结构,逐项判断.
解答 解:Y元素的最高正价与负价的代数和为6,最高正价和最低负价的绝对值的代数和为8,可知Y元素最高价+7,最低负价-1,Y是第ⅦA主族的元素,Y离子和M离子相同的电子层结构,则M位于Y所在周期的下一周期,
A.KCl中钾离子与氯离子电子层结构相同,氯元素处于第ⅦA主族,符合题意,故A正确;
B.NaF中离子有相同的电子层结构,但氟元素没有正化合价,故B错误;
C.Na2O中离子有相同的电子层结构,但氧离子不是第ⅦA主族的元素,故C错误;
D.NaCl中离子的电子层结构不同,氯离子含有三个电子层,钠离子含有两个电子层,故D错误,
故选:A.
点评 本题考查原子结构与性质,题目难度不大,根据最高正价与负价的关系判断Y元素的位置是解题的关键,结合选项再逐一验证,侧重于考查学生的分析能力和应用能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
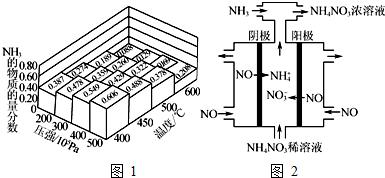
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| C(I-)/(mol•L-1) | C(Fe3+)/(mol•L-1) | ν/(mol•(L•s)-1) | |
| ① | 0.20 | 0.80 | 0.032k |
| ② | 0.60 | 0.40 | 0.144k |
| ③ | 0.80 | 0.20 | 0.128k |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4.5 | B. | 2.7 | C. | 3.3 | D. | 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
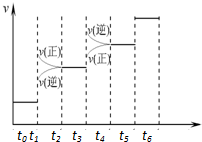 已知N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ•mol-1.请回答:(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示.图中tl时引起平衡移动的条件可能是增大压强.其中表示平衡混合物中NH3的含量最高的一段时是t2-t3.
已知N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ•mol-1.请回答:(1)当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如右图所示.图中tl时引起平衡移动的条件可能是增大压强.其中表示平衡混合物中NH3的含量最高的一段时是t2-t3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
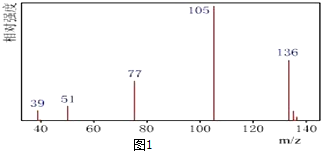
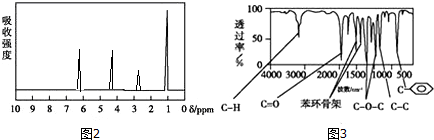
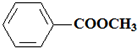 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们都含有 92个中子 | B. | 235U原子核外有143个电子 | ||
| C. | 它们互为同位素 | D. | 它们是同种核素 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 元素的非金属性次序为c>b>a | |
| B. | a和其他3种元素均能形成共价化合物 | |
| C. | 元素b、c的气态氢化物的稳定性:b<c | |
| D. | 元素b、c的最高价氧化物对应的水化物的酸性:b>c |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com