
����Ŀ����������mgij���壬����˫ԭ�ӷ��ӹ��ɣ�����Ħ������ΪMg��mol-1���������ӵ�������NA��ʾ����
��1������������ʵ���Ϊ________mol��
��2������������ԭ������Ϊ_______ _����
��3���������ڱ�״���µ����Ϊ____________L��
��4������������1Lˮ�У������Ƿ�Ӧ��������Һ�����ʵ���������Ϊ__ _��
��5������������ˮ���γ�VL��Һ������Һ�����ʵ���Ũ��Ϊ_____mol/L��
������֪ij����NaCl��Һ�����ΪVmL���ܶ�Ϊ��g/cm3����������Ϊw%�����ʵ���Ũ��Ϊcmol/L����Һ�к�NaCl������Ϊmg��
��1����m��V��ʾ��Һ���ʵ���Ũ�� ��
��2����w���ѱ�ʾ��Һ���ʵ���Ũ�� ��
��3����c���ѱ�ʾ��Һ���������� ��
��4����w��ʾ���¶���NaCl���ܽ�� ��
���𰸡�������1��![]() ��2��
��2��![]() ��3��
��3��![]() ��4��
��4��![]() ��5��
��5��![]()
������1��![]() mol/L��2��
mol/L��2��![]() mol/L��3��
mol/L��3��![]() %��4��
%��4��![]() g
g
��������
���������������1������mgij���壬����Ħ������ΪMg��mol-1������������ʵ���![]() ����Ϊ��
����Ϊ��![]() ����2��������Ϊ˫ԭ�ӷ��ӣ�����������ԭ������Ϊ
����2��������Ϊ˫ԭ�ӷ��ӣ�����������ԭ������Ϊ![]() ����Ϊ��
����Ϊ��![]() ����3���������ڱ�״���µ����Ϊ
����3���������ڱ�״���µ����Ϊ![]()
![]() ������
����Ϊ��![]() ����4������������1Lˮ�У������Ƿ�Ӧ��������Һ�����ʵ���������Ϊ
����4������������1Lˮ�У������Ƿ�Ӧ��������Һ�����ʵ���������Ϊ![]() ����Ϊ��
����Ϊ��![]() ����5������������ˮ���γ�VL��Һ������Һ�����ʵ���Ũ��Ϊ
����5������������ˮ���γ�VL��Һ������Һ�����ʵ���Ũ��Ϊ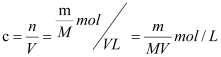 ����Ϊ��
����Ϊ��![]() ��������֪ij����NaCl��Һ�����ΪVmL���ܶ�Ϊ��g/cm3����������Ϊw%�����ʵ���Ũ��Ϊcmol/L����Һ�к�NaCl������Ϊmg����1����m��V��ʾ��Һ���ʵ���Ũ��
��������֪ij����NaCl��Һ�����ΪVmL���ܶ�Ϊ��g/cm3����������Ϊw%�����ʵ���Ũ��Ϊcmol/L����Һ�к�NaCl������Ϊmg����1����m��V��ʾ��Һ���ʵ���Ũ��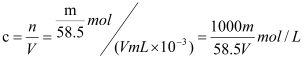 ����Ϊ��
����Ϊ��![]() mol/L����2����w���ѱ�ʾ��Һ���ʵ���Ũ��
mol/L����2����w���ѱ�ʾ��Һ���ʵ���Ũ�� ����Ϊ��
����Ϊ��![]() mol/L����3����c���ѱ�ʾ��Һ����������
mol/L����3����c���ѱ�ʾ��Һ����������![]() ����Ϊ��
����Ϊ��![]() %����4����w��ʾ���¶���NaCl���ܽ��
%����4����w��ʾ���¶���NaCl���ܽ��![]() ����Ϊ��
������![]() g��
g��


 ��ʦ����ָ���ο�ʱϵ�д�
��ʦ����ָ���ο�ʱϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.195gп�ۼ��뵽20.0mL��0.100molL��1MO2+��Һ�У�ǡ����ȫ��Ӧ����ԭ��������ǣ�������
A. M B. M2+ C. M3+ D. MO2+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij���������Ҫ��Ϊ�������ж������������ó���0.02 mg/L��
ijͬѧ������ͼ��ʾ����װ�òⶨ�����е�SO2������ȷ��ȡ10mL 5��10-4 mol/L������ˮ��Һ��ע����ͼ��ʾ�Թ��У���2��3�ε���ָʾ������ʱ��Һ����ɫ����ָ�����ⶨ�ص������ÿ�γ���100mL��ֱ����Һ����ɫȫ���ʾ�Ϊֹ�������ͬѧ�IJ�����ȷ�ģ����������Ĵ������ٴ��� ��ʱ����˵���ó������е�SO2������ꡣ

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ���ᴿ��������(������Ϊ����),��ѡ�����Լ��ͷ��뷽������ȷ����( )
ѡ�� | ���ᴿ������(����) | �����Լ� | ���뷽�� |
A�� | H2O(Br2) | CCl4 | ��ȡ��Һ |
B�� | MgCl2��Һ(AlCl3) | Ũ��ˮ | ���� |
C�� | CO2(HCl) | ����Na2CO3��Һ | ϴ�� |
D�� | Si(Al) | NaOH��Һ | ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������и���ֱ����ĸ�Ӱ�컯ѧ��Ӧ�������صĹ�ϵ��Ϊ���У�
��1�������ʳƷ�ױ�ù���ڶ��첻���������� ��
��2��ͬŨ�Ȳ�ͬ����������з���ͬ����С��п���þ�飬���������п����� ��
��3��MnO2����˫��ˮ�зų����ݸ��� ��
������һ���¶��£�4L�ܱ�������ijһ��Ӧ������M������N�����ʵ�����ʱ��仯��������ͼ��

��1���Ƚ�t2ʱ�̣����淴Ӧ���ʴ�СV�� V�森(���������=����������)
��2����t2=2min�����㷴Ӧ��ʼ��t2ʱ����M��Ũ�ȱ仯��ʾ��ƽ����Ӧ����Ϊ�� ��
��3��t3ʱ�̻�ѧ��Ӧ�ﵽƽ�⣬��Ӧ���ת����Ϊ ��
��4����������¶ȣ���V�� (������С��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ⱦ�ѳ�Ϊ����������ٵ��ش���в��������һ����Ҫ�Ļ�����Ⱦ��������γ���Ҫ�����ڣ� ��
A��ɭ�������ҿ��ҷ����ƻ�����̬ƽ��
B������ȼ���̻�����
C�������ж�����̼�ĺ�������
D������ȼ�պ���ȼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]����Ge���ǵ��͵İ뵼��Ԫ�أ��ڵ��ӡ����ϵ�����Ӧ�ù㷺���ش��������⣺
��1����̬Geԭ�ӵĺ�������Ų�ʽΪ[Ar]____________����__________��δ�ɶԵ��ӡ�
��2��Ge��C��ͬ��Ԫ�أ�Cԭ��֮������γ�˫������������Geԭ��֮�������γ�˫������������ԭ�ӽṹ�Ƕȷ�����ԭ����________________��
��3���Ƚ�������±������۵�ͷе㣬������仯���ɼ�ԭ��_____________________��
GeCl4 | GeBr4 | GeI4 | |
�۵�/�� | 49.5 | 26 | 146 |
�е�/�� | 83.1 | 186 | Լ400 |
��4�������ԭCO2�Ʊ�CH4��Ӧ�У���״����Zn2GeO4�Ǹ÷�Ӧ�����ô�����Zn��Ge��O�縺���ɴ���С��˳����______________��

��5��Ge�������н��ʯ�ͽṹ������Geԭ�ӵ��ӻ���ʽΪ_______________________����֮����ڵ���������_____________��
��6����������������Ҫ�أ�
��ԭ�������������ʾ�����ڲ���ԭ�ӵ����λ�ã���ͼΪGe�����ľ���������ԭ���������AΪ��0,0,0����BΪ��![]() ��0��
��0��![]() ����C��
����C��![]() ��
��![]() ��0������Dԭ�ӵ��������Ϊ______��
��0������Dԭ�ӵ��������Ϊ______��
���������������������Ĵ�С����״����֪Ge�����ľ�������a=565.76 pm�����ܶ�Ϊ__________g��cm-3���г�����ʽ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������⡿��������Ҫ��Ⱦ����SO2��NOx��������Ԥ�����������ʵ���Һ�������ɼ���������SO2��NOx�ĺ�����O3����������SO2��NOx����Ҫ��Ӧ���Ȼ�ѧ����ʽΪ��
NO(g)��O3(g)=NO2(g)��O2(g) ��H=��200.9 kJ��mol��1
NO(g)��1/2O2(g)=NO2(g) ��H=��58.2 kJ��mol��1
SO2(g)��O3(g)![]() SO3(g)��O2(g) ��H=��241.6 kJ��mol��1
SO3(g)��O2(g) ��H=��241.6 kJ��mol��1
��1����Ӧ3NO(g)��O3(g)=3NO2(g)�� ��H=_ ______ kJ��mol��1��
��2������������Ӧ2NO2(g)��O3(g)![]() N2O5(g)��O2(g)���Է����С����¶�ΪT1Kʱ�������Ϊ2L�ĺ����ܱ������г���1 mol O3��2 mol NO2������������Ӧ����25���ӷ�Ӧ��ƽ�⣬���ƽ��ʱN2O5(g)��Ũ��Ϊ0.25 mol��L��1��
N2O5(g)��O2(g)���Է����С����¶�ΪT1Kʱ�������Ϊ2L�ĺ����ܱ������г���1 mol O3��2 mol NO2������������Ӧ����25���ӷ�Ӧ��ƽ�⣬���ƽ��ʱN2O5(g)��Ũ��Ϊ0.25 mol��L��1��
���жϸ÷�Ӧ����S__ _____0����H_ ______0����>��<��=����
�����¶�ΪT1Kʱ�÷�Ӧ��ƽ�ⳣ��K= ��
������˵����ȷ���� ��
A���ӷ�Ӧ��ʼ����ƽ�⣬NO2��ƽ����Ӧ����v(NO2)=0.04mol��L��1��min��1
B��T1Kʱ������ʼʱ�������г���1 mol O3��2 mol NO2��1 mol O2��1 mol N2O5���壬��Ӧ�ﵽƽ��ǰv(��) <v(��)
C�����ı䷴Ӧ�¶�ΪT2K�����ƽ��ʱNO2��Ũ��Ϊ0.60 mol��L��1����T2>T1
D��T1Kʱ��Ӧ��ƽ��ʱ���������Ϊ2L����ά��T1Kѹ������ʹNO2ת����Ϊ60%�����ʱ���������ԼΪ0.71L
����ά�������������䣬���ı��¶�ΪT2Kʱ����15���ӷ�Ӧ��ƽ�⣬���ƽ��ʱN2O5(g)��Ũ��Ϊ0.20 mol��L��1��������T2K�´�0��25����c(NO2)��ʱ��仯ͼ��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com