
| A. | 自来水厂常用液氯给自来水消毒,主要是因为Cl2具有强氧化性 | |
| B. | 限制大排量汽车,也是防止酸雨的重要途径 | |
| C. | 镀金的钢铁器件既能增加美观,又可以在即使镀层局部破损后防止器件的损耗 | |
| D. | 乙醇可以发生的反应类型有:取代反应、消去反应、加成反应 |
分析 A.用液氯给自来水消毒,利用与氯气与水反应生成HClO的性质;
B.汽车尾气含氮、硫的氧化物,可导致酸雨发生;
C.镀层局部破损后形成原电池,Fe为负极;
D.乙醇不能发生加成反应.
解答 解:A.用液氯给自来水消毒,利用与氯气与水反应生成HClO的强氧化性,杀菌消毒、漂白等,故A错误;
B.汽车尾气含氮、硫的氧化物,可导致酸雨发生,则限制大排量汽车,也是防止酸雨的重要途径,故B正确;
C.镀层局部破损后形成原电池,Fe为负极,加快器件的损耗,故C错误;
D.乙醇不含碳碳双键,不能发生加成反应,故D错误;
故选B.
点评 本题考查物质的性质、用途等,综合性较强,综合考查元素化合物知识,把握物质的性质、原电池原理、环境保护等为解答的关键,注重基础知识的考查,题目难度不大.


 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案科目:高中化学 来源: 题型:选择题
| A. | 只要符合限量,“食用色素”、“亚硝酸盐”可以作为某些食品的添加剂 | |
| B. | 发泡塑料饭盒主要材质是高分子材料,不适于盛放含油较多的食品 | |
| C. | 蛋白质、淀粉、纤维素、油脂等都能在人体内水解并提供能量 | |
| D. | 纯净的二氧化硅是现代光学及光纤制品的基本原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol二甲醚中含有的C-O键的数目为2NA | |
| B. | 标准状况下,44.8 L四氯化碳中含有分子的数目为2NA | |
| C. | 200 g质量分数为23%的HCOOH水溶液中含氧原子的总数目为2NA | |
| D. | 在反应Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2中,每生成1 molCu,转移电子的数目为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 食醋中含有3%~5%的乙酸 | |
| B. | 黄酒变酸是因为部分乙醇氧化为乙酸 | |
| C. | 与甲酸甲酯互为同分异构体 | |
| D. | 通过乙酸乙酯的碱性水解直接获取 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加热可增强纯碱溶液去污力:CO32-+2H2O?H2CO3+2OH- | |
| B. | 用铁粉与高温水蒸气反应制取磁性氧化铁3Fe+4H2O$\frac{\underline{\;高温\;}}{\;}$Fe3O4+4H2 | |
| C. | 用烧碱溶液清洗铝表面的氧化膜:2OH-+Al2O3=2AlO2-+H2O | |
| D. | 用稀硝酸洗涤做过银镜反应的试管:3Ag+4H++NO3-=3Ag++NO↑++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与铜质水龙头连接处的钢质水管易发生腐蚀 | |
| B. | 明矾常作为净水剂,双氧水通常可用于杀菌消毒 | |
| C. | 金属钠、镁等活泼金属着火时,可以使用泡沫灭火器来灭火 | |
| D. | 神舟10号飞船所用太阳能电池板可将光能转换为电能,所用转换材料是硅 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 实验 | 现象 | 离子方程式 | |
| A |  | 在空气中放置一段时间后,溶液呈蓝色 | 4H++4I-+O2=2I2+2H2O |
| B | 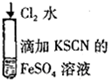 | 溶液由浅绿色变为红色 | 2Fe2++Cl2=2Fe3++2Cl- Fe3++3SCN-=Fe(SCN)3 |
| C |  | 溶液由黄绿色变为无色 | Cl2+2OH-=Cl-+ClO-+H2O |
| D |  | 有白色沉淀生成,溶液由红色变为无色 | Ba2++OH-+H++SO42-=BaSO4+H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

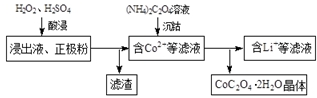
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com