
【题目】工业中很多重要的化工原料都来源于石油化工,如图中的苯、丙烯、有机物A等,其中A的产量可以用来衡量一个国家的石油化工发展水平。请回答下列问题:
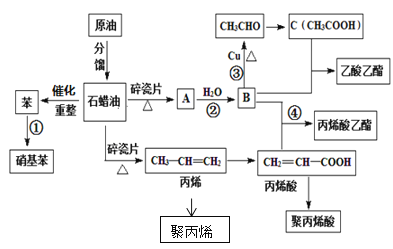
(1)A的结构简式为__,丙烯酸中官能团的名称为___。
(2)写出下列反应的反应类型①__,③___。
(3)用一种方法鉴别B和C,所用试剂是__。
(4)写出下列反应方程式:
丙烯→聚丙烯__;
丙烯酸+B→丙烯酸乙酯__。
【答案】CH2=CH2 碳碳双键、羧基 硝化反应或取代反应 氧化反应 Na2CO3或NaHCO3溶液或紫色石蕊试液 nCH2=CHCH3![]()
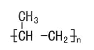 CH2=CHCOOH+CH3CH2OH
CH2=CHCOOH+CH3CH2OH![]() CH2=CHCOOCH2CH3+H2O
CH2=CHCOOCH2CH3+H2O
【解析】
B氧化生成C,且二者反应生成乙酸乙酯,则B为乙醇,C为乙酸,而A与水反应得到乙醇,则A为乙烯;乙醇与丙烯酸发生酯化反应生成丙烯酸乙酯;丙烯酸发生加聚反应得到聚丙烯酸;苯与浓硝酸在浓硫酸作催化剂、加热条件下发生取代反应生成硝基苯,据此分析。
(1)A为乙烯,含有碳碳双键,结构简式为:CH2=CH2;丙烯酸中官能团的名称为羧基和碳碳双键;
(2) 反应①是苯发生硝化反应生成硝基苯,属于取代反应;反应③是乙醇发生氧化反应生成乙醛;
(3) B是乙醇,官能团是羟基,C是乙酸,官能团是羧基,鉴别乙醇和乙酸可以利用乙酸的性质来鉴别,遇Na2CO3或NaHCO3溶液出现气体的是乙酸,使紫色石蕊试液变红的液体是乙酸;
(4) 丙烯发生加聚反应得到聚丙烯:化学反应方程式为:nCH2=CHCH3![]()
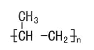 ;
;
丙烯酸和乙醇发生酯化反应得到丙烯酸乙酯和水,反应过程为酸脱去羟基,醇脱去氢原子,化学反应方程式为:CH2=CHCOOH+CH3CH2OH![]() CH2=CHCOOCH2CH3+H2O。
CH2=CHCOOCH2CH3+H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.CO2的分子结构模型:![]()
B.NaF、H2SO4中所含化学键类型相同
C.F2、Cl2、Br2、I2熔沸点逐渐升高
D.HCI气体溶于水和NaOH熔化破坏的化学键类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计二氧化碳熔盐捕获及电化学转化装置,其示意图如下:
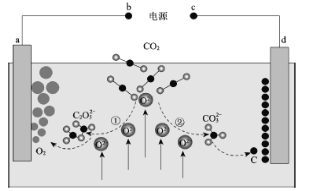
下列说法正确的是
A.b为电源的负极,d为电解池的阳极
B.过程①②中捕获CO2时碳的化合价发生了变化
C.a极的电极反应式为2C2O52--4e-=4CO2↑+O2↑
D.上述装置中总反应的化学方程式为C+O2=CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CPAE是蜂胶的主要活性成分,由咖啡酸合成CPAE路线如下:
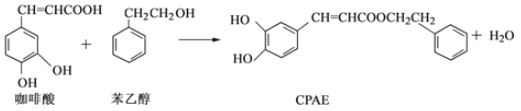
下列说法正确的是( )
A. 苯乙醇属于芳香醇,它与邻甲基苯酚互为同系物
B. 1molCPAE最多可与含3molNaOH的溶液发生反应
C. 用FeCl3溶液不可以检测上述反应中是否有CPAE生成
D. 咖啡酸、苯乙醇及CPAE都能发生取代、加成和消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应使用催化剂后,其反应过程中能量变化如图。下列说法错误的是
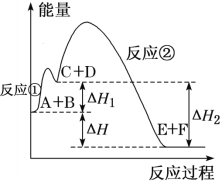
A.任何化学反应都伴随着能量的变化,能量变化主要是以热能的形式体现
B.总反应为反应物的总能量高于生成物总能量的反应,但反应①是吸热反应,
C.使用催化剂后,总反应的反应热不变、活化能减小
D.ΔH=ΔH2-ΔH1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1912年的诺贝尔化学奖授予法国化学家V.Grignard,用于表彰他所发明的Grignard试剂(卤代烃基镁)广泛运用于有机合成中的巨大贡献。Grignard试剂的合成方法是:RX+Mg ![]() RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)乙醚发生反应,再水解就能合成各种指定结构的醇:
RMgX(Grignard试剂)。生成的卤代烃基镁与具有羰基结构的化合物(醛、酮等)乙醚发生反应,再水解就能合成各种指定结构的醇:

现以2-丁烯和必要的无机物为原料合成3,4-二甲基-3-己醇,进而合成一种分子式为C10H16O4的具有六元环的物质J,合成线路如下:
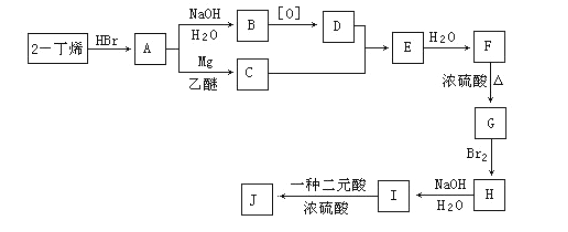
请按要求填空:
(1) 3,4-二甲基-3-己醇是: ____(填代号),E的结构简式是 ___;
(2)C→E的反应类型是 _____,H→I的反应类型是 ____;
(3)写出下列化学反应方程式(有机物请用结构简式表示):
A→B ___ , I→J _____ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:4NH3(g) + 5O2(g) =4NO(g) + 6H2O(g),△H= —1025kJ/mol,该反应是一个可逆反应,若反应物起始的物质的量相同,下列关于该反应的示意图不正确的是
A. 
B. 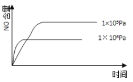
C. 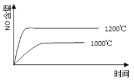
D. 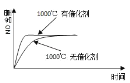
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如图,下列说法正确的是( )
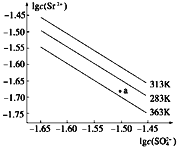
A. 283 K时,图中a点对应的溶液是不饱和溶液
B. 三个不同温度下,363 K时Ksp(SrSO4)最大
C. 温度一定时,Ksp(SrSO4)随c(SO42-)的增大而减小
D. 283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】叠氮化钠(NaN3)常用作汽车安全气囊中的药剂。实验室制取叠氮化钠的原理、实验装置及实验步骤如下:
①打开装置D导管上的旋塞,加热制取氨气。
②再加热装置A中的金属钠,使其熔化并充分反应后,再停止加热装置D并关闭旋塞。
③向装置A中b容器内充入加热介质并加热到210~220℃,然后通入N2O。
④冷却,向产物中加入乙醇(降低NaN3的溶解度),减压浓缩结晶后,再过滤,并用乙醚洗涤,晾干。

已知:I.NaN3是易溶于水的白色晶体,微溶于乙醇,不溶于乙醚;
II.NaNH2熔点210℃,沸点400℃,在水溶液中易水解。
请回答下列问题:
(1)装置B中盛放的药品为_____________;装置C的主要作用是______________________。
(2)步骤①中先加热通氨气的目的是_____________________________________;步骤②氨气与熔化的钠反应生成NaNH2的化学方程式为_______________________________。步骤③中最适宜的加热方式为 ___________(填“水浴加热”,“油浴加热”)。
(3)N2O可由NH4NO3在240~245℃分解制得(硝酸铵的熔点为169.6℃),则可选择的气体发生装置是(填序号)___________。

(4)生成NaN3的化学方程式为 _____________________________________。
(5)图中仪器a用的是铁质而不用玻璃,其主要原因是__________________。
(6)步骤④中用乙醚洗涤的主要目的是_______________________________。
(7)实验室用滴定法测定叠氮化钠样品中NaN3的质量分数:①将2.500 g试样配成500.00 mL溶液。②取50.00 mL溶液置于锥形瓶中,加入50.00 mL 0.1010 mol·L-1(NH4)2Ce(NO3)6溶液。③充分反应后,将溶液稍稀释,向溶液中加入8 mL浓硫酸,滴入3滴邻菲啰啉指示液,用0.0500mol·L-1(NH4)2Fe(SO4)2标准溶液滴定过量的Ce4+,消耗溶液体积为29.00mL。测定过程的反应方程式为:2(NH4)2Ce(NO3)6+2NaN3=4NH4NO3+2Ce(NO3)3+2NaNO3+3N2↑;Ce4++Fe2+=Ce3++Fe3+;试样中NaN3的质量分数为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com