
| A、1.12g |
| B、2.24g |
| C、3.24g |
| D、6.42g |


科目:高中化学 来源: 题型:

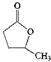
| 溴代试剂(NBS) |
| △ |
 ,请回答
,请回答查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用NaOH溶液提纯混有MgCl2杂质的AlCl3溶液 |
| B、用溴水和KSCN溶液判断FeBr3溶液中混有FeBr2. |
| C、用Ba(0H)2溶液可鉴别(NH4)2SO4、NH4Cl、Na2SO4、NaCl四种溶液 |
| D、用硝酸钡溶液和硝酸检验亚硫酸钠固体是否变质 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 4 |
| 7 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 800℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 | 现象 | 结论 | |
| A |  | 先生成白色沉淀,滴加FeCl3溶液后生成红褐色沉淀 | Fe(OH)3是比Mg(OH)2更难溶的电解质 |
| B |  | 试管B中导管内液面升高 | 铁钉生锈的原因主要是吸氧腐蚀 |
| C |  | 观察到量筒内黄绿色逐渐消失,量筒内壁有油状物质生成 | 甲烷与氯气在光照条件下发生了加成反应 |
| D |  | 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向转移 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | 现象或操作 | 解释 |
| A | 向KI淀粉溶液中通入氯气,溶液颜色变蓝 | 氯气与淀粉发生显色反应 |
| B | 蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口处 | 此位置指示的是被蒸馏物质的沸点 |
| C | 向某溶液中加入硝酸酸化的氯化钡溶液,有白色沉淀生成 | 说明该溶液中含有SO42- |
| D | 向某物质的溶液中加入紫色石蕊试液,溶液变蓝 | 说明该物质一定是碱 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com