
| A. | ①②④⑤ | B. | ②④⑤ | C. | ③④⑤ | D. | ①②⑤ |
分析 根据n=$\frac{V}{{V}_{m}}$计算VL氨气的物质的量,根据m=nM计算氨气的质量,根据m=ρV计算水的质量,进而计算溶液的质量,进而计算溶液的质量,根据V=$\frac{m}{ρ}$计算溶液的体积;
①溶液的密度ρ=$\frac{m(溶液)}{V(体积)}$;
②ω=$\frac{m(氨气)}{m(溶液)}$;
③C=$\frac{1000ρω}{M}$;
④溶液质量分数ω=$\frac{m(氨气)}{m(氨气)+m(水)}$;
⑤根据c=$\frac{n}{V}$计算溶液物质的量浓度.
解答 解:①VL氨气的物质的量为:$\frac{V}{22.4}$mol,氨气质量为$\frac{17V}{22.4}$g,1L水的质量为1000mL×1g/mL=1000g,故溶液质量为($\frac{17V}{22.4}$+1000)g,溶液体积为:V=$\frac{n}{c}$=$\frac{\frac{V}{22.4}mol}{cmol/L}$,所以溶液的密度为:ρ=$\frac{\frac{17V}{22.4}+1000}{\frac{V}{22.4c}}$=$\frac{17c+22400c}{V}$g/mL,故错误;
②ω=$\frac{m(氨气)}{m(溶液)}$=$\frac{17cV}{1000Vρ}$=$\frac{17c}{1000ρ}$,故正确;
③C=$\frac{1000ρω}{M}$=$\frac{1000ρω}{17}$,故错误;
④溶液质量分数ω=$\frac{m(氨气)}{m(氨气)+m(水)}$=$\frac{\frac{17V}{22.4}}{1000+\frac{17V}{22.4}}$=$\frac{17V}{22400+17V}$,故正确;
⑤V=$\frac{\frac{17V}{22.4}+1000}{1000ρ}$L=$\frac{17V+22400}{22400}$L,溶液的物质的量浓度为c=$\frac{\frac{17V}{22.4}mol}{\frac{17V+22400}{22400}L}$=$\frac{1000Vρ}{17V+22400}$,故正确.
故选B.
点评 本题考查物质的量及其浓度的计算,题目难度中等,明确物质的量与物质的量浓度、摩尔质量等物理量之间的关系为解答关键,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:选择题
| A. | 0.5L 2mol/LBaCl2溶液中,钡离子和氯离子总数约为3NA | |
| B. | 从1L 1mol/L的NaCl溶液中取出10mL,其浓度仍为1mol/L | |
| C. | 配置0.5L 10mol/L的盐酸,需要标准状况下的氯化氢气体112L | |
| D. | 10mL质量分数为98%的硫酸,用水稀释至100mL,硫酸的质量分数为9.8% |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-b KJ/mol | |
| B. | C2H2(g)+$\frac{5}{2}$ O2(g)═2CO2(g)+H2O(l)△H=+2b KJ/mol | |
| C. | 2C2H2(g)+5O2(g)═4CO2(g)+2H2O(l)△H=-4b KJ/mol | |
| D. | C2H2(g)+O2(g)═CO2(g)+H2O(l)△H=+b KJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 32g氧气和臭氧混合物中氧原子的物质的量为2 mol | |
| B. | 2mol的硫酸的摩尔质量为196g/mol | |
| C. | 一定温度和压强下,各种气态物质的体积由构成气体分子的大小决定 | |
| D. | 将58.5gNaCl溶于941.5g水中配成1mol/L的NaCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 醋中的醋酸和大理石发生了离子反应 | |
| B. | 醋中的醋酸使大理石氧化 | |
| C. | 醋中的醋酸使大理石还原 | |
| D. | 醋中的水使大理石溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,22.4L氢气中含有2NA个中子 | |
| B. | 0.1NA个氯化氢分子占有体积为2.24L | |
| C. | 2克金属钙变成钙离子时失去的电子数为0.1NA | |
| D. | 50mL0.1mol/L H2SO4溶液中含有H+数为0.005NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molFeSO4•7H2O的质量为278g/mol | |
| B. | FeSO4•7H2O的摩尔质量为278g | |
| C. | 配制100mL 0.1mol/L FeSO4溶液需要FeSO4•7H2O 2.78g | |
| D. | 配制100mL 0.1mol/L FeSO4溶液需要FeSO4•7H2O 1.52g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
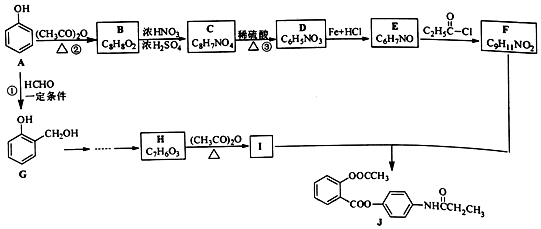
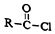 +R′-NH2→
+R′-NH2→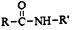 +HCl
+HCl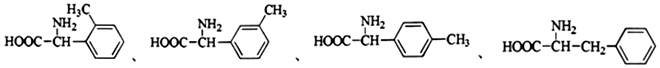 .
.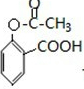 ;合成过程中设计步骤②和③的目的是保护酚羟基不被氧;
;合成过程中设计步骤②和③的目的是保护酚羟基不被氧;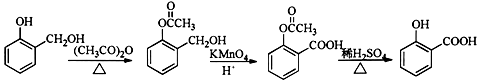 .
.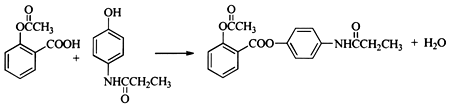 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com