
以冶铝的废弃物铝灰为原料制取超细α-氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下:
(1)铝灰中氧化铝与硫酸反应的化学方程式为 。
(2)图中“滤渣”的主要成分为 (填化学式)。
(3)加30%的H2O2溶液发生的离子反应方程式为 。
(4)煅烧硫酸铝铵晶体,发生的主要反应为:
4[NH4Al(SO4)2·12H2O]  2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
2Al2O3 + 2NH3↑+ N2↑+ 5SO3↑+ 3SO2↑+ 53H2O,将产生的气体通过下图所示的装置。
①集气瓶中收集到的气体是 (填化学式)。
②足量饱和NaHSO3溶液吸收的物质除大部分H2O(g)外还有 (填化学式)。
③KMnO4溶液褪色(MnO4-还原为Mn2+),发生的离子反应方程式为 。
(1)Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O(2分)
(2)SiO2(2分)
(3)2Fe2++H2O2+2H+ = 2Fe3++2H2O(2分)
(4)①N2(2分)②SO3、NH3(2分,缺漏不给分)。
③2MnO4- +5SO2 + 2H2O = 2Mn2+ + 5SO42-+4H+(2分)
解析试题分析:(1)氧化铝为两性氧化物与酸、碱均反应;(2)铁的氧化物和氧化铝溶于酸,二氧化硅不溶形成滤渣;(3)溶液中的亚铁离子不易除去,需把其氧化为铁离子再沉淀除去;(4)①通过饱和亚硫酸氢钠溶液除去氨气、三氧化硫,通过高锰酸钾溶液除去二氧化硫气体,故收集的气体为氮气;②SO3、NH3均溶解于水与水反应;③KMnO4溶液与二氧化硫反应,二氧化硫被氧化为硫酸根离子。
考点:考查工业流程中的化学原理有关问题。


科目:高中化学 来源: 题型:单选题
在下列溶液中,各组离子一定能够大量共存的是
| A.pH=2的溶液:Fe3+、Cu2+、SO42-、NO3- |
| B.c(H+)=1×10-12mol/L的溶液:NH4+、K+、Cl-、AlO2- |
| C.水电离的c(H+)=1×10-12mol/L的溶液:Na+、Al3+、Br-、ClO- |
| D.与铝反应放出氢气的溶液:Na+、Mg2+、Br-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)已知反应:3NO2+H2O==2HNO3+NO,回答下列问题:
(1)该反应的离子方程式为 。
(2)氧化剂与还原剂的质量比为 ,氧化产物与还原产物的物质的量之比为 。
(3)在标准状况下,3.36L NO2与H2O完全反应转移的电子数目为 。
(4)写出HNO3与石灰水反应的离子方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
炼金废水中含有络离子[Au(CN)2]+,其电离出的CN—有毒,CN-与H+结合生成HCN时,其毒性更强。回答下列问题:
(1)HCN的电离方程式为______________________NaCN溶液的pH_____7(填“< > =”)
(2)与弱电解质的电离方程式相似,[Au(CN)2]+也存在着两步电离,其一级电离方程式为_________
(3)处理这种废水是在碱性条件下,NaClO将CN—氧化为碳酸根和氮气,其离子方程式为:__________
(4)在酸性条件下,ClO—也能氧化CN--,但实际处理废水时却不在酸性条件下进行的原因是_______________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
黑火药爆炸时发生多种化学反应,其中主要化学反应方程式为:
2KNO3+3C+S K2S+N2↑+3CO2↑
K2S+N2↑+3CO2↑
(1)上述反应中,原子半径最小的元素其原子结构示意图为________________。
(2)上述反应生成物中,属于非电解质的是________。
(3)上述反应中,每生成1 mol氧化产物,消耗KNO3的质量为 (保留1位小数)。
(4)收集黑火药爆炸后的烟尘和气体产物,分别与酸性高锰酸钾溶液反应,均能使溶液紫红色退去。
①烟尘中能使酸性高锰酸钾溶液退色的物质是 (填化学式)。
②气体产物与酸性高锰酸钾溶液反应的离子方程式 。
③利用下图装置检验气体产物中的CO气体,一段时间后,观察到B中出现黑色的Pd沉淀,写出B中发生反应的化学方程式 。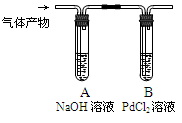
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(14分)二氧化钛广泛应用于各类结构表面涂料、纸张涂层等,二氧化钛还可作为制备钛单质的原料。
Ⅰ.二氧化钛可由以下两种方法制备:
方法1:TiCl4水解生成TiO2·xH2O,过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2,此方法制备得到的是纳米二氧化钛。
(1)①TiCl4水解生成TiO2·xH2O的化学方程式为 。
②检验TiO2·xH2O中Cl-是否被除净的方法是 。
方法2:可用含有Fe2O3的钛铁矿(主要成分为FeTiO3,其中Ti元素化合价为+4价)制取,其主要流程如下: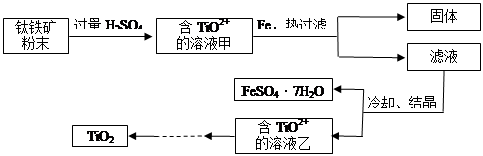
(2)Fe2O3与H2SO4反应的离子方程式是 。
(3)甲溶液中除含TiO2+之外还含有的金属阳离子有 。
(4)加Fe的作用是 。
Ⅱ、二氧化钛可用于制取钛单质
(5)TiO2制取单质Ti,涉及到的步骤如下:
TiO2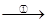 TiCl4
TiCl4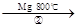 Ti
Ti
反应②的方程式是 ,该反应需要在Ar气氛中进
行,请解释原因: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
现有五种可溶性物质A、B、C、D、E,它们所含的阴、阳离子互不相同,分别含有五种阳离子K+、Fe3+、Cu2+、Ba2+、Al3+和五种阴离子Cl-、OH-、 、
、 、X中的一种。
、X中的一种。
(1)某同学通过比较分析,认为无需检验就可判断其中必有的两种物质是________和________。
(2)物质C中含有离子X。为了确定X,现将(1)中的两种物质记为A和B,当C与A的溶液混合时产生蓝色沉淀,向该沉淀中滴入足量稀HNO3,沉淀部分溶解,剩余白色固体。则X为________(填字母)。
A.Br- B.
C.CH3COO- D.
(3)将19.2 g Cu投入装有足量D溶液的试管中,Cu不溶解,再滴加稀H2SO4,Cu逐渐溶解,管口附近有红棕色气体出现,写出Cu溶解的离子方程式:________________,若要将Cu完全溶解,至少加入H2SO4的物质的量是________。
(4)若用惰性电极电解C和D的混合溶液,溶质的物质的量均为0.1 mol,请在坐标系中画出通电后阴极析出固体的质量m与通过电子的物质的量n的关系。(标明纵坐标数值)
(5)E溶液与氢碘酸反应时可生成棕色物质,该反应的离子方程式为______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某无色溶液X,由K+、NH4+、Ba2+、Al3+、Fe3+、CO32—、SO42—
中的若干种离子组成,取该溶液进行如下实验: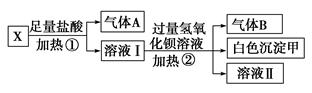
(1)白色沉淀甲是________。
(2)试写出实验过程中生成气体A、B的离子方程式
__________________________、_______________________________
(3)通过上述实验,可确定X溶液中一定存在的离子是
________,尚未确定是否存在的离子是________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下面是同学们熟悉的物质:
①O2 ②金刚石 ③NaBr ④H2SO4 ⑤Na2CO3
⑥NH4Cl ⑦NaHSO4 ⑧Ne ⑨Na2O2 ⑩NaOH
(1)这些物质中,只含有共价键的是________;只含有离子键的是________;既含有共价键又含有离子键的是________;不存在化学键的是________。
(2)属于共价化合物的是________;属于离子化合物的是________。
(3)将NaHSO4溶于水,破坏了NaHSO4中的________,写出其电离方程式_________________________;
NaHSO4在熔融状态下电离,破坏了________,写出其电离方程式____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com