
下列离子方程式表达正确的是( )
A.向氯化铁溶液中滴加HI溶液:2Fe3+ + 2HI = 2Fe2++2H++I2
B.向NH4Al(SO4)2溶液中滴入Ba(OH)2恰好使SO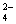 反应完全:
反应完全:
2Ba2++4OH—+Al3++2SO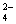 ==2BaSO4↓+AlO
==2BaSO4↓+AlO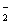 +2H2O
+2H2O
C.1mol/L的NaAlO2溶液和2.5 mol/L的HCl等体积均匀混合:
2AlO2-+5H+ = Al(OH)3↓+Al3++H2O
D.用过氧化氢从酸化的海带灰浸出液中提取碘:2I-+H2O2==I2+2OH--
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列有关溶液组成的描述合理的是
A.无色溶液中可能大量存在Al3+、NH4+、Cl-、S2-
B.甲基橙变红的溶液中可能大量存在Na+、ClO-、SO42-、I-
C.弱碱性溶液中可能大量存在Na+、K+、Cl-、HCO3-
D.中性溶液中可能大量存在Fe3+、K+、Cl-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
有A、B、C、D、E五种短周期元素,已知相邻的A、B、C、D四种元素原子核外共有56个电子,在周期表中的位置如图所示。E的单质可与酸反应,1molE单质与足量酸作用,在标准状况下能产生33.6LH2;E的阳离子与A的阴离子核外电子层结构完全相同。
回答下列问题:
(1)A与E形成的化合物的化学式是 。
(2)B的最高价氧化物化学式为 ,
C的元素名称为 ,
D的单质与水反应的离子方程式为_ 。
(3)写出D、E两元素最高价氧化物的水化物溶液反应的化学方程式
。
查看答案和解析>>
科目:高中化学 来源: 题型:
美籍华裔科学家钱永键、日本科学家下修村和美国科学家马丁•沙尔菲因在发现和研究绿色荧光蛋白(GFP)方面做出突出贡献而分享诺贝尔化学奖。经研究发现GFP中的生色基团结构如下图所示,下列有关GFP的说法中正确的是( )
A.该有机物属于芳香烃
B.1mol该有机物分子中含有7mol碳碳双键
C.该有机物与溴水既能发生加成反应,又能发生取代反应
D.该有机物所有原子都有可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。2分
(2)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
① 此时溶液中c(SO32–)的浓度是0.2 mol·L-1,则溶液中c(HSO3–)是_______mol•L-1。
② 向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是 。2分
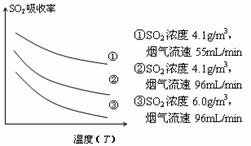
③ 某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示。则: ,有利于提高SO2的吸收效率。2分
(3)工厂仓库存放的Na2SO3药品已部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定其含量,具体步骤如下:
步骤i 称取样品1.000 g。
步骤ii 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤iii 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01000 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
① 写出步骤iii所发生反应的离子方程式_________________________________;
② 在配制0.01000 mol·L-1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量________(填“偏大”、“偏小”或“无影响”)。
③ 某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是 (填字母)。
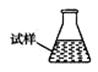
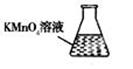

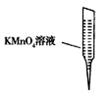
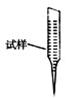
A B C D E
④ 滴定结果如下表所示:
| 滴定次数 | 待测溶液 的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
则该药品中Na2SO3的质量分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
化工生产中通常有“三酸两碱”之说,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质分类的角度分析,上述说法中不恰当的一种物质是__________,(填化学式)。
(2)向盐酸中加入浓H2SO4时,会有白雾生成。下列叙述不属于导致产生该现象的原因的是__________(填序号)。
A.浓H2SO4具有脱水性 B.盐酸具有挥发性
C.气体溶质的溶解度随温度升高而降低
(3)“三酸”常用于溶解金属和金属氧化物
①下列块状金属在常温下能够全部溶于足量的浓硝酸的是______(填序号);
A.Au B.Ag C.Al D.Fe
②金属铜投入稀硫酸中不发生反应,但再加入H2O2溶液后铜开始溶解,溶液逐渐变为蓝色,写出该反应的离子方程式__________________________。
(4)烧碱、纯碱溶液均可吸收CO2气体。当含0.1molNaOH的溶液吸收一定量CO2后,将溶液小心低温蒸干,称得固体质量为8g,则所得固体是____________(填化学式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有机物的名称正确的是
A.2,2-二甲基-3-戊烯 B.4,5-二甲基-3-乙基己烷
C.2,3,3-三甲基丁烷 D.2,3-二甲基-4-乙基已烷
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式正确的是
A.钠与水反应:
B.硅酸钠溶液与醋酸溶液混合: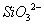 +
+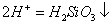
C.0.01mol/LNH4Al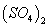 溶液与0.02mol/LBa(OH)2溶液等体积混合:
溶液与0.02mol/LBa(OH)2溶液等体积混合:
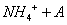 1
1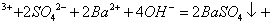 A1
A1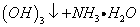
D.向次氯酸钙溶液通入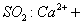
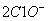 +
+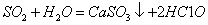
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com