
化学与社会、生活密切相关,下列说法正确的是
A.加碘食盐中添加的是碘化钾
B.味觉上具有酸味的食物就是酸性食物
C.Fe3O4俗称铁红,常做红色油漆和涂料
D.晶体硅具有半导体性质,可用于生产计算机芯片
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015学年上海市十三校高三第二次联考化学试卷(解析版) 题型:选择题
对某酸性溶液(可能含有Br、SO42、H2SO3、NH4+)分别进行如下实验:
①加热时放出的气体可以使品红溶液褪色
②加碱调至碱性后,加热时放出的气体可以使湿润的红色石蕊试纸变蓝
③加入数滴氯水时,溶液无色,再加入BaCl2溶液时,产生的白色沉淀不溶于稀硝酸。
对于下列物质不能确认其在溶液中是否存在的是
A.Br B.SO42 C.H2SO3 D.NH4+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省扬州市高三上学期期末考试化学试卷(解析版) 题型:实验题
(16分)高纯碳酸锰在电子工业中有重要的应用,湿法浸出软锰矿(主要成分为MnO2,含少量Fe、Al、Mg等杂质元素)制备高纯碳酸锰的实验过程如下:
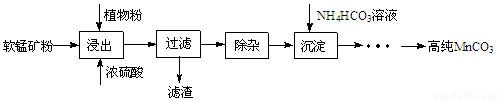
(1)浸出:浸出时温度控制在90℃~95℃之间,并且要连续搅拌3小时的目的是 ,植物粉的作用是 。
(2)除杂:①向浸出液中加入一定量的碳酸锰矿,调节浸出液的pH为3.5~5.5;
②再加入一定量的软锰矿和双氧水,过滤;
③…
操作①中使用碳酸锰调pH的优势是 ;操作②中加入双氧水不仅能将Fe2+氧化为Fe3+,而且能提高软锰矿的浸出率。写出双氧水提高软锰矿浸出率的离子方程式 。
(3)制备:在30 ℃~35 ℃下, 将碳酸氢铵溶液滴加到硫酸锰净化液中,控制反应液的最终pH在6.5~7.0,得到MnCO3沉淀。温度控制35 ℃以下的原因是 ;该反应的化学方程式为 ;生成的MnCO3沉淀需经充分洗涤,检验洗涤是否完全的方法是 。
(4)计算:室温下,Ksp(MnCO3)=1.8×10-11,Ksp(MgCO 3)=2.6×10-5 ,已知离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。
3)=2.6×10-5 ,已知离子浓度小于1.0×10-5mol·L-1时,表示该离子沉淀完全。若净化液中的c(Mg2+)=10-2mol/L,试计算说明Mg2+的存在是否会影响MnCO3的纯度。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省扬州市高三上学期期末考试化学试卷(解析版) 题型:选择题
下列有关化学用语表示正确的是
A.HClO的结构式:H—Cl—O
B.羟基的电子式:
C.NaHCO3在水中的电离方程式:NaHCO3=Na++H++CO32-
D.异丙醇的结构简式:CH3CH2CH2OH[来
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三4月质量检查理综化学试卷(解析版) 题型:填空题
(14分)甲、乙、丙三种物质均由短周期元素组成,一定条件下,存在下列转化关系:
甲+乙→丙+H20
(1)若丙为Na2C03,反应的化学方程式为 (任写一个)。
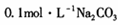 溶液中,所含的离子按物质的量浓度由大到小的顺序排列为 。
溶液中,所含的离子按物质的量浓度由大到小的顺序排列为 。
(2)若甲是石油裂解气的主要成分之一,乙为O2,且甲分子和乙分子具有相同的电子数。25℃、101 kPa时,1g甲完全燃烧生成CO2气体与液态水,放出50.5 kJ的热量,该反应的热化学方程式为 ;利用该反应设计的燃料电池中,通入甲的电极为电池的 (填“正极”或“负极”)。
(3)若甲、乙是同主族元素的化合物,丙为单质。
①丙所含元素在元素周期表中的位置为
②甲与水相比,热稳定性较强的是 (填化学式)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三4月质量检查理综化学试卷(解析版) 题型:选择题
下列工业生产的主要反应中,涉及置换反应的是
A.制取粗硅 B.海水提镁 C.电解制铝 D.制备硫酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年陕西省西安市高三下学期二模考试理综化学试卷(解析版) 题型:简答题
(15分)重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放。
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强。为回收利用,通常采用如下流程处理:
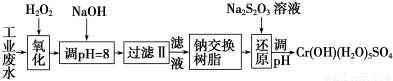
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表。
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
(1)氧化过程中可代替H2O2加入的试剂是________(填序号)。
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是________;已知钠离子交换树脂的原理:Mn++nNaR―→MRn+nNa+,此步操作被交换除去的杂质离子是__________。
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8 mol Cr2O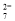 转移4.8 mol e-,该反应离子方程式为________________。
转移4.8 mol e-,该反应离子方程式为________________。
Ⅱ.酸性条件下,六价铬主要以Cr2O 形式存在,工业上常用电解法处理含Cr2O
形式存在,工业上常用电解法处理含Cr2O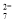 的废水:
的废水:
该法用Fe作电极电解含Cr2O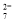 的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液。
(1)电解时能否用Cu电极来代替Fe电极?________(填“能”或“不能”),理由是______________。
(2)电解时阳极附近溶液中Cr2O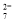 转化为Cr3+的离子方程式为___________________。
转化为Cr3+的离子方程式为___________________。
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为____时才能使c(Cr3+)降至10-5 mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省淮北市高三第二次模拟考试理综化学试卷(解析版) 题型:选择题
煤矸石是采煤和洗煤时的废弃物,其主要成分是Al2O3、SiO2,另外还含有数量不等的Fe2O3、CaO、MgO、Na2O、K2O、P2O5、SO3和微量稀有元素(如Ga等)。下列关于煤矸石的说法正确的是
A.可用于生产矸石水泥、耐火砖等建筑材料
B.煤矸石中的金属氧化物均为碱性氧化物
C.P2O5和SO3对应水化物的酸性较强的是 H3PO4
D.铝比镓活泼,能电解GaCl3水溶液制备镓单质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com