
选考[化学——选修5:有机化学基础](13分)
阿托酸乙酯可用于辅助胃肠道痉挛及溃疡。阿托酸乙酯的一种合成路线如下图所示:

请回答下列问题:
(1)E的分子式为 ,F的结构简式 ,阿托酸乙酯所含官能团的名称 ;
(2)在反应①②③④⑤⑥⑦⑧中,属于取代反应的有 ;
(3)反应③的方程式 。
(4)有关阿托酸乙酯的说法正确的是( )
A.能使高锰酸钾褪色,不能使溴水褪色
B.1mol阿托酸乙酯最多能与4molH2加成
C.能发生加成、加聚、氧化、水解等反应
D.分子式为C11H13O2
(5)D的同分异构体有多种,符合含有苯环且能与碳酸氢钠反应放出气体的同分异构体有 种(不包含D)。
(1)C10H12O2 (1分)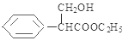 (2分) 碳碳双键、酯基(2分)(2)②⑤⑥(1分)
(2分) 碳碳双键、酯基(2分)(2)②⑤⑥(1分)
(3)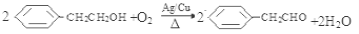 (2分);
(2分);
(4)B、C (2分) (5)3 (2分)。
【解析】
试题分析:苯乙烯与溴化氢发生加成反应生成的产物在氢氧化钠的水溶液中发生取代反应,生成B,则B为苯乙醇,B与氧气发生氧化反应,生成苯乙醛,则C是苯乙醛,苯乙醛被氢氧化铜氧化、酸化后得到苯乙酸,所以D是苯乙酸,D与乙醇发生酯化反应,生成苯乙酸乙酯,则E为苯乙酸乙酯,E与甲酸甲酯发生取代反应,生成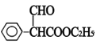 ,
, 与氢气加成反应,醛基变为羟基,生成F
与氢气加成反应,醛基变为羟基,生成F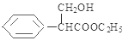 ,则F在发生消去反应生成产物阿托酸乙酯。
,则F在发生消去反应生成产物阿托酸乙酯。
(1)根据以上分析,E为苯乙酸乙酯,其分子式是C10H12O2;F的结构简式为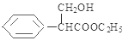 ;阿托酸乙酯所含官能团的名称是碳碳双键和酯基;
;阿托酸乙酯所含官能团的名称是碳碳双键和酯基;
(2)根据以上分析,在反应①②③④⑤⑥⑦⑧中,属于取代反应的有②⑤⑥;
(3)反应③是B与氧气发生氧化反应,生成苯乙醛,化学方程式是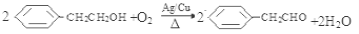 ;
;
(4)A、阿托酸乙酯分子中含有碳碳双键,可以使高锰酸钾溶液和溴水褪色,错误;B、阿托酸乙酯分子中的碳碳双键和苯环都与氢气发生加成反应,所以1mol阿托酸乙酯最多能与4molH2加成,正确;C、阿托酸乙酯中含有碳碳双键,可发生加成反应、加聚反应、氧化反应,含有酯基,可发生取代反应或水解反应,正确;D、其分子式中的H原子不可能为单数,所以分子式为C11H12O2,错误,答案选BC;
(5)D为苯乙酸,含有苯环且能与碳酸氢钠反应放出气体的同分异构体中含有羧基,所以符合条件的D的同分异构体有邻、间、对-甲基苯甲酸3种。
考点:考查有机物的推断,官能团的判断,反应类型的判断,同分异构体的判断等


科目:高中化学 来源:2014-2015学年山东省高三上学期期末考试化学试卷(解析版) 题型:选择题
X、Y、Z、W有如图所示的转化关系,则X、Y可能是
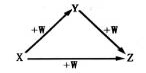
①C、CO ②AlCl3 Al(OH)3 ③N2、NO ④S、SO2
A.②③ B.①② C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通市高三第一次模拟化学试卷(解析版) 题型:选择题
25℃时,下列各组离子在指定溶液中一定能大量共存的是
A.pH=1的无色溶液中:Na+、Cu2+、Cl-、CO32-
B.使酚酞呈红色的溶液中:K+、Na+、NO3-、Cl-
C.0.1 mol/L的FeCl2溶液中:H+、Al3+、SO42-、ClO-
D.由水电离出的c(H+)=1×10-10mol/L的溶液中:Mg2+、NH4+、SO42-、HCO3-
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三第五次检测考试理综化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】(15分)
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的_________区;溴的价电子排布式为____________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是_________。
氟 | 氯 | 溴 | 碘 | |
第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图1、2所示:

请比较二者酸性强弱:HIO3_____ H5IO6(填“>”、 “<”或“=”)。
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
(6)图3为碘晶体晶胞结构。有关说法中正确的是____________。
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(图4)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三第五次检测考试理综化学试卷(解析版) 题型:选择题
已知 一紫罗兰酮的结构简式是
一紫罗兰酮的结构简式是 ,关于该有机物的说法正确的是
,关于该有机物的说法正确的是
A.其分子式为C13H18O
B.能使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色
C.属于芳香族化合物
D.能发生加成反应、取代反应、水解反应
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市八校高三第二次联考化学试卷(解析版) 题型:填空题
(10分)某铝合金中含有铁、铝、镁、铜、硅。为了测定该合金中铝的含量,现设计了如下实验:
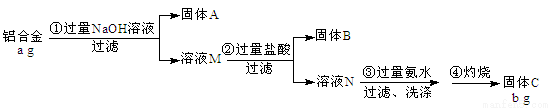
已知:Si+ 2NaOH + H2O = Na2SiO3 + 2H2↑,H2SiO3是不溶于水的弱酸。
(1)固体A的成分是:____________,溶液M中的阴离子有:____________________
(2)步骤③中生成沉淀的离子方程式为:_____________________________________
(3)该样品中铝的质量分数是:_______________________________(用a、b表示)。
(4)下列因操作不当,会使测定结果偏大的是___________
A.第①步中加入NaOH溶液不足 B.第②步中加入盐酸不足时
C.第④步中的沉淀未用蒸馏水洗涤 D.第④步对沉淀灼烧不充分
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市八校高三第二次联考化学试卷(解析版) 题型:选择题
下列事实说明HNO2为弱电解质的是
①0.1 mol/L HNO2溶液的pH=2.1; ②常温下NaNO2溶液的pH>7 ;
③用HNO2溶液做导电实验时,灯泡很暗; ④HNO2溶液和KCl溶液不发生反应
⑤HNO2能与碳酸钠反应制CO2; ⑥HNO2不稳定,易分解
A.①②③⑤ B.①②④⑤ C.①②⑥ D.①②
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省龙岩市一级达标校高三上学期期末化学试卷(解析版) 题型:选择题
向恒温恒容密闭容器中加入1molHI,发生下列反应2HI(g) H2(g)+I2(g),△H >0。达到平衡后,往容器中再加入1molHI,有关说法正确的是
H2(g)+I2(g),△H >0。达到平衡后,往容器中再加入1molHI,有关说法正确的是
A.平衡不移动,HI平衡转化率不变
B.平衡向右移动,HI平衡转化率不变
C.平衡向左移动,HI平衡转化率减小
D.平衡向右移动,HI平衡转化率增大
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西岐山县高二上学期期末考试化学(文)试卷(解析版) 题型:选择题
下列物质是你在生活中经常遇到的物质,其中属于纯净物的
A.煤 B.生铁 C.矿泉水 D.蒸馏水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com