
【题目】卤代烯烃是合成塑料的重要原料,研究合成卤代烯烃具有重要意义。T℃时,在10L的密闭容器中充入1mol2—丁炔(CH3—C≡C—CH3,可用X表示)和1molHCl,以Al2O3为催化剂发生如下反应:
Ⅰ.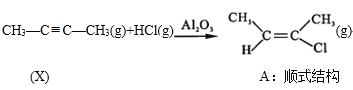 ΔH=akJ/mol(a<0)
ΔH=akJ/mol(a<0)
Ⅱ.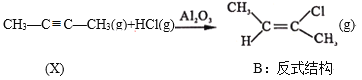 ΔH=bkJ/mol(b<0)
ΔH=bkJ/mol(b<0)
已知B比A更稳定,且产物A、B在混合物中的物质的量随时间变化如图一所示。试回答下列问题。
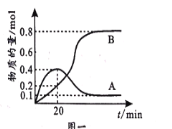
(1)发生反应I、Ⅱ的同时,还有反应A转化为B,且焓变为△H'。则△H'_0(填“>”、“<”或“=”)。
(2)①从反应开始至20min时生成B的平均速率v(B)=___;
②反应至20min时CH3—C≡C—CH3的转化率=__;
③在T℃时,反应I的平衡常数为__。
(3)T℃时,E1和E2分别代表反应I,Ⅱ的正反应活化能。
①由图一得出:E1__E2(填“>”、“<”或“;”);
②试从反应方向的角度分析,20min后A的物质的量减小的原因__。
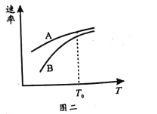
(4)其它条件相同时,测出生成A、B的速率随温度变化如图二所示,则提高B在较低温度下产率的措施是__。
【答案】< 1×10-3mol/(L·min) 60% 100 < B的能量低,A转化为B为放热反应,有利于A自发转化为B 加入低温下适合生成B的高性能催化剂
【解析】
根据盖斯定律,两式相减可得反应热;根据v=![]() 计算B表示的平均速率;
计算B表示的平均速率;
转化率=![]() ×100%;在T℃时,根据平衡时各物质的物质的量浓度计算反应I的平衡常数;其它条件相同时,相同温度下生成A、B 的速率不同,反应I、Ⅱ都使用催化剂,从催化剂的活性考虑提高B的生成速率的方法。
×100%;在T℃时,根据平衡时各物质的物质的量浓度计算反应I的平衡常数;其它条件相同时,相同温度下生成A、B 的速率不同,反应I、Ⅱ都使用催化剂,从催化剂的活性考虑提高B的生成速率的方法。
(1)已知:
Ⅰ.CH3-C≡C-CH3(g)+HCl(g)![]()
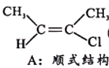 (g) H=akJ/mol(a<0)
(g) H=akJ/mol(a<0)
Ⅱ.CH3-C≡C-CH3(g)+HCl(g)![]()
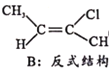 (g) H=bkJ/mol(b<0)
(g) H=bkJ/mol(b<0)
根据盖斯定律,Ⅱ-Ⅰ可得
![]()
 △H'=(b-a) kJ/mol,已知B比A更稳定,则反应Ⅱ放出的热量比反应I多,故b<a,(b-a)<0,即△H'<0,反应放热;
△H'=(b-a) kJ/mol,已知B比A更稳定,则反应Ⅱ放出的热量比反应I多,故b<a,(b-a)<0,即△H'<0,反应放热;
(2)①结合图示,从反应开始至20 min时生成B的物质的量为0.2mol,根据v=![]() ,v(B)=
,v(B)= =1×10-3mol/(Lmin);
=1×10-3mol/(Lmin);
②反应I、Ⅱ都在发生,反应至20 min时,根据图象,生成A、B的量分别为0.2mol、0.4mol,根据反应I、Ⅱ可得CH3-C≡C-CH3的消耗量为0.2mol+0.4mol=0.6mol,转化率=![]() ×100%=
×100%=![]() ×100%=60%;
×100%=60%;
③反应I的产物为A,在T℃时,根据图象,平衡时反应I生成A的物质的量为0.1mol,反应Ⅱ生成B的物质的量为0.8mol,则平衡时CH3-C≡C-CH3的物质的量为1mol-0.1mol-0.8=0.1mol,HCl的物质的量为1mol-0.1mol-0.8=0.1mol,反应I平衡常数K=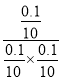 =100;
=100;
(3)①根据图象所示,20 min前,A的产量高于B,说明生成产物A的活化能较低,反应速率快,故E1<E2;
②根据B比A更稳定,说明B的能量低,A转化为B为放热反应,有利于A自发转化为B;
(4)相同温度下生成A、B 的速率不同,反应I、Ⅱ都使用催化剂,其它条件相同时,催化剂对反应I、Ⅱ生成A、span>B的催化效果不同,提高B在较低温度下产率的措施应为加入低温下适合生成B的高性能催化剂。


科目:高中化学 来源: 题型:
【题目】某课题研究小组设计如下图所示装置(电极材料均为铂),该装置可将工业废水中的乙胺(CH3CH2NH2)转化成无毒无害物质。下列分析错误的是

A. 电极N为电池的负极
B. 电池工作时,H+由右极区通过交换膜移动到左极区
C. N电极的电极反应方程式为2CH3CH2NH2+8H2O-30e-=4CO2↑+N2↑+30H+
D. 当空气(假设含氧气20%)的进入量为7.5mol时,可以处理含乙胺9%(质量分数)的废水0.1kg
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下在密闭容器中发生反应:2M(g)+N(g) 2E(g)。若开始时只充入2 mol E(g),达平衡时,混合气体的压强比起始时增大了20%;若开始时只充入2 mol M和1 mol N的混合气体,达到平衡的M的转化率为
A.60%B.80%C.20%D.40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】支撑海港码头基础的钢管柱,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助阳极。下列有关表述不正确的是

A. 通入保护电流使钢管桩表面腐蚀电流接近于零
B. 通电后外电路电子被强制从高硅铸铁流向钢管桩
C. 高硅铸铁的作用是作为损耗阳极材料和传递电流
D. 通入的保护电流应该根据环境条件变化进行调整
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卫生部发出公告,自2011年5月1日起,禁止在面粉生产中添加过氧化钙(CaO2)等食品添加剂。CaO2和Na2O2在结构和性质上有很多相似的地方。请完成下列问题:
(1)CaO2属于____(填“离子化合物”或“共价化合物”),其电子式为_____,其阴、阳离子个数比为______。
(2)CaO2与水反应的化学方程式为______,生成1mol单质气体,转移的电子数为__________。(用NA代表阿伏加德罗常数)
(3)CaO2与二氧化碳反应的化学方程式为_________,该反应属于____________。
A.置换反应 B.氧化还原反应 C.复分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】食盐是日常生活的必需品,也是重要的化工原料。
(1)粗食盐中常含有少量K+、Ca2+、Mg2+、Fe3+、SO42-等杂质离子,实验室提纯NaCl的流程如下:

提供的试剂:饱和Na2CO3溶液 饱和K2CO3溶液 NaOH溶液 BaCl2溶液 Ba(NO3)2溶液 75%乙醇 四氯化碳
①欲除去溶液Ⅰ中的Ca2+、Mg2+、Fe3+、SO42-,选出a所代表的试剂,按滴加顺序依次为________(只填化学式)。
②分离操作①中所用到的玻璃仪器有____________。
③洗涤除去NaCl晶体表面附带的少量KCl,选用的试剂为________。
(2)用提纯的NaCl配制450 mL 4.00 mol·L-1NaCl溶液,所用仪器除药匙、烧杯、玻璃棒外还有________(填仪器名称)。
(3)在实验中多次用到玻璃棒,其作用有三个,分别是______________、______________、______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有硫酸钠和碳酸钠混合溶液10.0 mL,加入足量氯化钡溶液,充分反应后,经过滤、洗涤和干燥,得到白色沉淀1.451 g。将沉淀与过量盐酸反应,得到112 mL 二氧化碳气体(在标准状况下)。求原混合溶液中硫酸钠和碳酸钠的物质的量浓度分别是多少?________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用如图装置,进行NH3与金属氧化物MxOy反应生成M、N2、H2O,通过测量生成水的质量来测定M的相对原子质量。a中试剂是浓氨水。

①仪器a的名称为_________,仪器b中装入的试剂可以是___________。
②按气流方向正确的装置连接顺序为_________(填字母,装置可重复使用)。
(2)亚硝酸钠是一种工业盐,在生产、生活中应用广泛。现用下图所示装置(夹持装置已省略)及药品,探究亚硝酸钠与硫酸反应及气体产物成分。
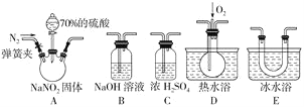
已知:ⅰ.NO+NO2+2OH-=2NO2-+H2O
ⅱ.气体液化的温度:NO2(21℃)、NO(-152℃)
①反应前应打开弹簧夹,先通入一段时间氮气,目的是________________。
②为了检验装置A中生成的气体产物,仪器的连接顺序(从左向右连接):A→_________;组装好仪器后,接下来进行的操作是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系,据此判断下列说法正确的是 ( )
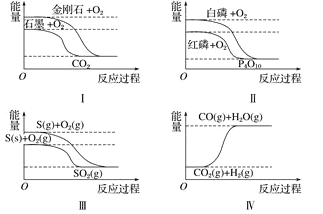
A.金刚石比石墨稳定
B.红磷转变为白磷是吸热反应
C.S(g)+O2(g) === SO2(g) ΔH1 ;S(s)+O2(g) === SO2(g) ΔH2,则ΔH1>ΔH2
D.CO(g)+H2O(g) === CO2(g)+H2(g) ΔH>0
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com