(2011?丰台区一模)工业上将纯净干燥的氯气通入到物质的量浓度为0.375mol/LNaOH溶液中得到漂水.某同学想在实验室探究Cl
2性质并模拟制备漂水,如图是部分实验装置.已知KMnO
4与盐酸溶液反应可以制取Cl
2.
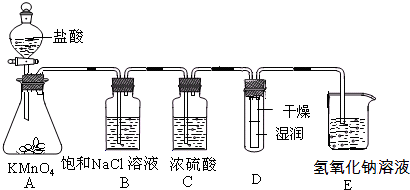
(1)配制物质的量浓度为0.375mol/LNaOH溶液时,主要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒和
容量瓶
容量瓶
.
(2)浓硫酸的作用是
干燥氯气
干燥氯气
.
(3)装置E中发生化学反应的离子方程式为
Cl2+2OH-=Cl-+ClO-+H2O
Cl2+2OH-=Cl-+ClO-+H2O
.
(4)装置B中饱和NaCl溶液可用于除去Cl
2中的HCl气体,已知氯气与水的反应是一个可逆反应,请简述饱和NaCl溶液除去Cl
2中HCl气体的原理(用离子方程式表示和文字说明)
HCl溶于水电离出的H+和饱和NaCl溶液中的Cl-都会对反应Cl2+H2O?H++Cl-+HClO起到抑制作用
HCl溶于水电离出的H+和饱和NaCl溶液中的Cl-都会对反应Cl2+H2O?H++Cl-+HClO起到抑制作用
.
(5)实验时装置D中湿润的红色纸条褪色,干燥部分没有褪色,放置一段时间后,纸条全部褪色.该同学认为Cl
2的密度比空气大,可能是试管下部Cl
2的浓度大于试管上部Cl
2的浓度所导致的.请判断该解释是否合理
不合理
不合理
,并分析产生上述实验现象的原因
实验进行中Cl2与湿润红色纸条中的水反应生成HClO使湿润的红色纸条褪色,干燥部分没有HClO,所以纸条不褪色,放置一段时间,由于水分子运动会导致整个纸条湿润而褪色
实验进行中Cl2与湿润红色纸条中的水反应生成HClO使湿润的红色纸条褪色,干燥部分没有HClO,所以纸条不褪色,放置一段时间,由于水分子运动会导致整个纸条湿润而褪色
;如需改进,请简述设计方案
取一塑料板将干燥的红色纸条和湿润的红色纸条分别贴在塑料板两侧,将该装置放入装置D中或将氯气先通入装有干燥的红色纸条的试管,再通入装有湿润的红色纸条的试管中
取一塑料板将干燥的红色纸条和湿润的红色纸条分别贴在塑料板两侧,将该装置放入装置D中或将氯气先通入装有干燥的红色纸条的试管,再通入装有湿润的红色纸条的试管中
(若认为合理.则此问可不作答).
(6)氯元素含量为10%的漂水溶液355g,其中含NaClO的物质的量为
0.5
0.5
mol.



