

 CO2(g)+H2(g)
CO2(g)+H2(g)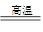 CO+H2 CH4+H2O(g)
CO+H2 CH4+H2O(g) CO+3H2 (2)合成塔 N2+3H2
CO+3H2 (2)合成塔 N2+3H2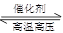 2NH3 (3)冷却塔 n 高温气体由冷却塔的上端进入,冷却水应从下端进入,逆向冷却效果好 (4)将液氨和未反应的原料气分离
2NH3 (3)冷却塔 n 高温气体由冷却塔的上端进入,冷却水应从下端进入,逆向冷却效果好 (4)将液氨和未反应的原料气分离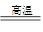 CO+H2、CH4+H2O(g)
CO+H2、CH4+H2O(g) CO+3H2;(2)合成氨的设备为合成塔;发生的反应是N2+3H2
CO+3H2;(2)合成氨的设备为合成塔;发生的反应是N2+3H2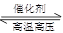 2NH3;(3)冷凝分离氨气的设备为冷却塔;为了增强冷却效果,冷却水应从下端进入,逆向冷却效果好;(4)设备C是分离器,能将液氨和未反应的原料分离;(5)设CO、H2O的起始浓度分别为x mol·L-1、y mol·L-1,且CO的转化率为90%,则
2NH3;(3)冷凝分离氨气的设备为冷却塔;为了增强冷却效果,冷却水应从下端进入,逆向冷却效果好;(4)设备C是分离器,能将液氨和未反应的原料分离;(5)设CO、H2O的起始浓度分别为x mol·L-1、y mol·L-1,且CO的转化率为90%,则 CO2(g)+H2(g)
CO2(g)+H2(g)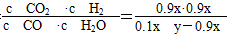 =0.627,得:
=0.627,得: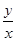 ≈13.8,只要增加H2O量,就可提高CO的转化率。
≈13.8,只要增加H2O量,就可提高CO的转化率。

科目:高中化学 来源:不详 题型:单选题
| A.打开汽水瓶有气泡从溶液中冒出 |
| B.实验室用排饱和食盐水法收集氯气 |
| C.合成氨工厂学采用增大压强以提高原料的利用率 |
| D.由H2、I2(g)、HI气体组成的平衡减压后颜色变浅 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| c(H2) |
| c(NH3) |
| A.保持容器的容积不变,升高了温度 |
| B.保持容器压强和温度不变,向容器内补充了Ar(g) |
| C.保持容器容积和温度不变,向容器内补充了N2 |
| D.保持容器容积和温度不变,液化分离走部分NH3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀 |
| B.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0 |
| C.加热0.1mol/LNa2CO3溶液,CO32-的水解程度和溶液的pH均增大 |
| D.对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 C(g)+D(g),其中a为正整数。反应过程中,当其他条件不
C(g)+D(g),其中a为正整数。反应过程中,当其他条件不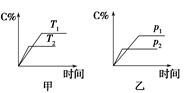
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 CH3OH (g) DH1
CH3OH (g) DH1 CH3OH (g)+H2O(g) DH2
CH3OH (g)+H2O(g) DH2| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
| CO的初始浓度(mol/L) | 2 | 4 | 1 | 3 |
| H2的初始浓度(mol/L) | 3 | 2 | 3 | 3 |
| 时间(min) | 8 | 6 | 12 | n |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 4NO(g)+6H2O(g),下列说法正确的是( )
4NO(g)+6H2O(g),下列说法正确的是( )| A.达到化学平衡时,4v正(O2)=5v逆(NO) |
| B.若单位时间内生成xmol NO的同时消耗xmol NH3,则反应达到平衡状态 |
| C.达到平衡状态时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
| D.化学反应速率关系是:2v正(NH3)=3v正(H2O) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g) ΔH=-92.2 kJ·mol-1,测得0到10 s内,c(H2)减小了0.75 mol·L-1,下列说法正确的是( )
2NH3(g) ΔH=-92.2 kJ·mol-1,测得0到10 s内,c(H2)减小了0.75 mol·L-1,下列说法正确的是( )| A.10 s到15 s内c(NH3)增加量等于0.25 mol·L-1 |
| B.10 s内氨气的平均反应速率为0.025 mol·L-1·s-1 |
| C.达平衡后,分离出少量NH3,v正增大 |
| D.该反应的逆反应的活化能不小于92.2 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2C(气);△H<0 ,经 2 s(秒)后测得 C 的浓度为0.6 mol·L-1 ,现有下列几种说法:
2C(气);△H<0 ,经 2 s(秒)后测得 C 的浓度为0.6 mol·L-1 ,现有下列几种说法:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com