
| A. | 单质的密度都很小,属于轻金属,且随核电荷数的增加依次增大 | |
| B. | 单质的熔点都很低,导电性、导热性都很好,如液态钠可作核反应堆的传热介质 | |
| C. | 单质与氧气反应时都只能生成氧化物或过氧化物 | |
| D. | 在Na、K、Rb三种单质中,Rb的熔点最高 |
 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法肯定错误的是( )
近年来,科学家合成了一系列具有独特化学特性的氢铝化合物(AlH3)n.已知,最简单的氢铝化合物的分子式为Al2H6,它的熔点为150℃,燃烧热极高.Al2H6球棍模型如图.下列有关说法肯定错误的是( )| A. | Al2H6在固态时所形成的晶体是分子晶体 | |
| B. | 氢铝化合物可能成为未来的储氢材料和火箭燃料 | |
| C. | Al2H6中含有离子键和极性共价键 | |
| D. | Al2H6在空气中完全燃烧,产物为氧化铝和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素X与Z、Y 与W形成的化合物都为离子化合物 | |
| B. | 元素X与Y,Z与Y形成的二元化合物都只有一种 | |
| C. | Y、Z、W三种元素形成的离子半径随原子序数的增加而增大 | |
| D. | 元素W、R的最高价氧化物的水化物都是强酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①④ | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青铜、黄铜、碳素钢都属于合金 | |
| B. | 棉、麻、丝、有机玻璃都是天然高分子材料 | |
| C. | 糖类、油脂、蛋白质的组成元素完全相同 | |
| D. | 石英玻璃、陶瓷和水泥都是硅酸盐产品 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 沸点 |
| 乙醚 | 34.6℃ |
| 乙醇 | 78.2℃ |
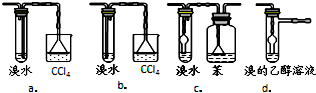

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com