
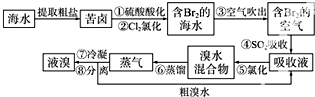
分析 空气吹出法是用于工业规模海水提溴的常用方法,其中一种工艺是在预先经过酸化的浓缩海水中,用氯气置换溴离子使之成为单质溴,继而通入空气和水蒸气,将溴吹入吸收塔,使溴蒸汽和吸收剂二氧化硫发生作用转化成氢溴酸以达到富集的目的,也就是得到富集溴.然后,再用氯气将其氧化得到产品溴,
(1)根据溴在氯的下一周期,与氯在同一主族来解答;
(2)因SO2和氯气、水反应生成硫酸和氢溴酸;
(3)在溴水中,溴的沸点是58.5°C,水的是100°C,温度80℃-90℃时,水不沸腾而溴蒸气挥发;
(4)根据分液是分离两种不相溶的液体,用分液漏斗分离;
(5)海水中溴离子的浓度较少,在海水提取溴之前,必须进行海水浓缩以节约成本;
解答 解:(1)因溴在氯的下一周期,与氯在同一主族,所以溴在周期表中位于第4周期VIIA族,故答案为:4,VIIA;
(2)因SO2和氯气、水反应生成硫酸和氢溴酸:Br2+SO2+2H2O=2HBr+H2SO4,故答案为:Br2+SO2+2H2O=4H++2Br-+SO42-;
(3)在溴水中,溴的沸点是58.5°C,水的是100°C,温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低,
故答案为:温度过高,大量水蒸气随之排出,溴气中水分增加;温度过低,溴不能完全蒸出,产率低;
(4)因液溴与溴水不相溶,用分液漏斗分离,故答案为:分液漏斗;
(5)海水中溴离子的含量较少,在海水提取溴之前,必须进行海水浓缩,
故答案为:“空气吹出、SO2吸收、氯化”的过程实际上是一个Br2的浓缩过程,与直接蒸馏含Br2海水相比效率更高,消耗能源少,成本降低.
点评 本题主要以海水化学资源的利用为背景,考查的知识点较多,培养了学生运用知识分析问题和解决问题的能力,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 该物质与乙炔互为同系物 | |
| B. | 能使酸性高锰酸钾溶液褪色 | |
| C. | 不能发生加聚反应 | |
| D. | 可由乙炔和含氮化合物通过取代反应制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 还原性:F->Cl->Br->I- | |
| B. | 酸性:碳酸>石碳酸>碳酸氢钠>氢氧化铝 | |
| C. | 氧化性:Na>S>F2>O2 | |
| D. | NaHCO3溶液:c(HCO3-)>c(CO32-)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C15H31COOH和C17H35COOH是同系物 | |
| B. | 结构不同,性质相同,化学式相同的物质互称同分异构体 | |
| C. | 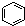 和 和 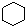 均是芳香烃, 均是芳香烃,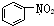 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 | |
| D. | 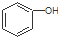 和 和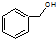 分子组成相差一个-CH2-,因此是同系物关系 分子组成相差一个-CH2-,因此是同系物关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题


 ,G
,G .
. .
. 氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式
氮原子上的氢原子可以像A上的氢原子那样与C发生加成反应,再缩聚成高分子化合物.写出尿素与C在一定条件下生成线性高分子化合物的化学方程式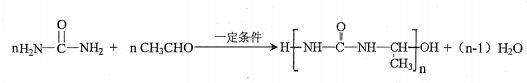 .
.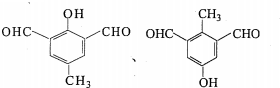 (任一种).
(任一种).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com