
【题目】下列关于氯水的说法正确的是( )
A. 新制氯水含有Cl2、HCl、HClO、H2O分子
B. 紫色石蕊试剂滴入新制氯水中,溶液先变红后变无色
C. 氯水和液氯都能使干燥的有色布条褪色
D. 新制氯水的pH值要比久置氯水的pH值小
科目:高中化学 来源: 题型:
【题目】CoCl2·6H2O是一种饲料营养强化剂。以含钴废料(含少量Fe、Al等杂质)制取CoCl2·6H2O的一种新工艺流程如下图:
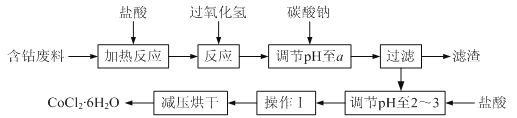
已知:①CoCl2·6H2O熔点86℃,易溶于水、乙醚等;常温下稳定无毒,加热至110~120℃时,易失去结晶水变成有毒的无水氯化钴。(乙醚:无色液体,沸点34.5℃,在水中的溶解度小)
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
开始沉淀 | 2.3 | 7.5 | 7.6 | 3.4 |
完全沉淀 | 4.1 | 9.7 | 9.2 | 5.2 |
请回答下列问题:
(1)钴的性质与铁相似,能与盐酸和硝酸反应,写出钴与盐酸反应的化学方程式:________________________________。
(2)在上述新工艺中,用“盐酸”代替原工艺中“盐酸与硝酸的混酸”直接溶解含钴废料,其主要优点:
①为__________________________,防止大气污染;
②防止产品中混有硝酸盐。
(3) 加入碳酸钠调节pH至a,a的范围应是5.2~_________。
(4) 操作Ⅰ包含3个基本实验操作,它们是蒸发浓缩、冷却结晶和_________。
(5)根据表中数据,判断Ksp[Fe(OH)3] ________Ksp[Co(OH)2] (填“<”、“=”或“>”) 。在实验室中,为了从上述产品中获得纯净的CoCl2·6H2O,采用的方法是:将产品溶于乙醚过滤后,再蒸馏。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH和Na2CO3的混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如下图所示。下列判断正确的是

A. 在0-a范围内,只发生中和反应
B. ab段发生反应的离子方程式为CO32- +2H+ = CO2 ↑+H2O
C. a = 0.3
D. 原混合溶液中NaOH和Na2CO3的物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是
A. 醋酸溶解水垢中的CaCO3:CaCO3+2H+ = Ca2++H2O+CO2↑
B. NaAlO2溶液中通入过量CO2: AlO2-+CO2+2H2O = Al(OH)3↓+HCO3-
C. 用热的NaOH溶液溶解S:3S+4OH-![]() 2S2-+SO2↑+2H2O
2S2-+SO2↑+2H2O
D. 稀硫酸与氢氧化钡溶液反应:H+ + OH-+SO42-+ Ba2+= BaSO4↓ + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知299 K时,合成氨反应N2(g ) + 3H2 ( g )![]() 2NH3( g ) △H =" -92.0" kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
2NH3( g ) △H =" -92.0" kJ/mol,将此温度下的1 mol N2和3 mol H2放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
A. 一定大于92.0 kJ B. 一定等于92.0 kJ
C. 一定小于92.0 kJ D. 不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铁的“氧化物”样品,用5mol/L盐酸0.14L恰好完全反应,所得溶液还能吸收标准状况下2.24L氯气,使其中Fe2+全部转化为Fe3+.该样品可能的化学式是( )
A. Fe5O6 B. Fe3O4 C. Fe6O7 D. Fe5O7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:

(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近观察到的现象是 。
②Y电极上的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应式是 。
②Y电极的材料是 ,电极反应式是 。
(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢H2O2(氧的化合价为﹣1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
A.Na2O2+2HCl===2NaCl+H2O2
B.Ag2O+H2O2===2Ag+O2+H2O
C.2H2O2===2H2O+O2
D.3H2O2+Cr2(SO4)3+10KOH===2K2CrO4+3K2SO4+8H2O
(1)H2O2仅体现氧化性的反应是_________(填代号)。
(2)H2O2既体现氧化性又体现还原性的反应是_________(填代号)。
(3)在稀硫酸中,KMnO4和H2O2能发生氧化还原反应。
氧化反应:H2O2﹣2e﹣===2H++O2↑
还原反应:MnO![]() +5e﹣+8H+===Mn2++4H2O
+5e﹣+8H+===Mn2++4H2O
写出该氧化还原反应的离子方程式:___________________。
(4)在K2Cr2O7+14HCl===2KCl+3Cl2↑+7H2O+2CrCl3的反应中,有0.3 mol电子转移时生成Cl2的体积为______(标准状况),被氧化的HCl的物质的量为____。
(5)除去镁粉中混入的铝粉杂质用溶解、_______方法,化学反应方程式为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知20℃时,饱和NaCl溶液的密度为ρg/cm3,物质的量浓度为c mol/L,则下列说法中不正确的是
A. 温度低于20℃时,饱和NaCl溶液的浓度小于c mol/L
B. 此溶液中NaCl的质量分数为![]()
C. 20℃时,密度小于ρg/cm3的NaCl溶液是不饱和溶液
D. 20℃时,饱和NaCl溶液的溶解度![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com