
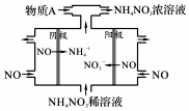
 NO2是形成雾霾天气的原因之一.
NO2是形成雾霾天气的原因之一.分析 (1)在排气管内将尿素溶液采用喷淋的形式与NO2作用,可结合影响反应速率的因素考虑,活化能是化学反应本身的性质,与影响反应的条件无关;NO2中氮元素为+4价,转化为N2中0价,化合价降低4价,CO(NH2)2中氮元素-3价,转化为N2中0价,化合价降得6价,故最小公倍数为24,故NO2前系数为产6,CO(NH2)2前系数为产4,再结合原子守恒配平生成物;
(2)依据热化学方程式和盖斯定律计算①+②+③得到CO2与NH3合成尿素和气态水的热化学反应方程式;
(3)判断可逆反应2NH3(g)+CO2(g)?CO(NH2)2(s)+H2O(g),是否达到平衡状态,可结合平衡状态的特征v(正)=v(逆)≠0,反应体系各物质的量不再随时间变化而变化来判断;
转化率=$\frac{消耗量}{起始量}×100%$,可结合“三行式”计算CO2的转化率;平衡体系中改变固体反应物或生成物的量不影响反应速率,不影响平衡的移动;
(4)电解NO制备 NH4NO3,由装置图可知阳极发生氧化反应,NO被氧化生成NO3-,阴极发生还原反应,NO被还原生成NH4+,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,结合电极方程式解答该题.
解答 解:(1)尿素以喷淋的形式进入排气管,可增大与NO2气体的接触面积,加快了反应速率,但不改变反应的活化能;NO2中氮元素为+4价,转化为N2中0价,化合价降低4价,CO(NH2)2中氮元素-3价,转化为N2中0价,化合价降得6价,故最小公倍数为24,故NO2前系数为产6,CO(NH2)2前系数为产4,再结合原子守恒配平生成物;
故答案为:增大接触面积,加快反应速率;不变;6; 4;7; 4; 8;
(2)①2NH3(g)+CO2(g)=NH2CO2NH4(s)△H=-l59.5kJ•mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(l)△H=-160.5kJ•mol-1
③H2O(l)=H2O(g)△H=+44.0kJ•mol-1
依据热化学方程式和盖斯定律计算①+②+③得到CO2与NH3合成尿素和气态水的热化学反应方程式为2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g)△H=-276.0KJ/mol;
故答案为:2NH3(g)+CO2(g)=CO(NH2)2(s)+H2O(g)△H=-276.0 KJ/mol;
(3)a.反应前后气体反应物和生成物的系数和不等,正反应是体积减小的方向,在恒温恒容条件下,压强不变是平衡状态,故a正确;b.伴随反应的进行,CO2与NH3的速率之比始终为1:2,无法判断是平衡状态,故b错误;c.NH2CO2NH4(s)质量保持不变可说明是平衡状态,故c正确;d.反应在恒温条件下进行,无法判断是平衡状态,故d错误;
2NH3+CO2?NH2CO2NH4,
起始量(mol/L) 0.2 0.1 0
变化量(mol/L) 0.1 0.05 0
平衡量(mol/L) 0.1 0.05 0
CO2的转化率=$\frac{消耗量}{起始量}$×100%=$\frac{0.05mpl/l}{0.1mol/l}$=50%
改变NH2CO2NH4(s)质量平衡不移动,CO2的转化率不变;
故答案为:ac;50%;不变;
(4)电解NO制备NH4NO3,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总电极反应方程式为:8NO+7H2$\frac{\underline{\;通电\;}}{\;}$3NH4NO3+2HNO3可知补充的A为NH3,使NO全部转化为NH4NO3总化学反应方程式是8NO+2NH3+7H2O=5NH4NO3;
故答案为:8NO+2NH3+7H2O=5NH4NO3.
点评 本题考查盖斯定律的应用、平衡状态的判断、化学反应速率的影响因素、转化率的计算及电解原理的应用等,题目难度中等,侧重于考查学生对基础知识的综合应用能力.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:多选题
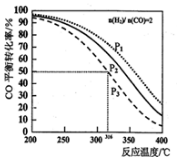
| A. | 上述反应△H<0 | |
| B. | 图中P1<P2<P3 | |
| C. | 若在P3和316℃时,测得容器中n(H2)=n(CH3OCH3),此时v(正)<v(逆) | |
| D. | 若在P3和316℃时,起始时$\frac{n({H}_{2})}{n(CO)}$=3,则达到平衡时,CO转化率小于50% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
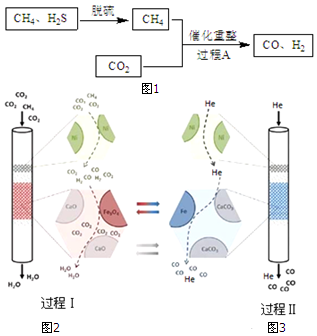
| 编号 | 催化剂 | 是否添加CaO | 还原产物 |
| 1 | Fe3O4 | 添加 | 有Fe |
| 2 | Fe3O4 | 不添加 | 无Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 试验操作 | 现象 | 结论 |
| A | 向浓度为0.1molL-1MgSO4、CuSO4混合溶液中逐滴加入NaOH溶液 | 先看到蓝色沉淀生成 | Ksp[Cu(OH)2]<Ksp[Mg(OH)2] |
| B | 测量熔融状态下NaHSO4 | 能导电 | 熔融状态下NaHSO4能电离出Na+、H+、SO42- |
| C | 向某溶液中滴加NaOH溶液并将湿润的红色石蕊试纸置于试管口 | 试纸颜色没变化 | 原溶液中无NH4+ |
| D | 向Fe(NO)2溶液中加入0.1mol•L-1H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+ 还原为NO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=+90.3 | |
| B. | 恒温恒压下,在已达平衡的反应I体系中再充入少量He时平衡正向移动 | |
| C. | 其他条件不变,加压对反应Ⅱ的反应速率无影响 | |
| D. | 其他条件不变,升高温度可提高反应Ⅲ中CO2的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升高a的反应温度,乙醇的转化率增大 | |
| B. | 由b可知:乙醇的燃烧热为13.8kJ•mol-1 | |
| C. | 对反应b来说,增大O2浓度可使△H2的值增大 | |
| D. | 以上两种途径,制取等量的氢气,无论哪种途径,消耗的能量均相同. |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,Cu-Zn原电池中,正极产生1.12LH2时,转移的电子数应小于0.1NA | |
| B. | 1molSO2与足量O2在一定条件下反应生成SO2,共转移2NA个电子 | |
| C. | 2.1gDTO中所含中子数为NA | |
| D. | 常温常压下,28gC2H4、CO的混合气体中含有碳原子的数目为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L水中含有1molH2SO4 | |
| B. | 1L溶液中含有1molH+ | |
| C. | 将98gH2SO4溶于1L水中配成上述溶液 | |
| D. | 1L硫酸溶液中含有96gSO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
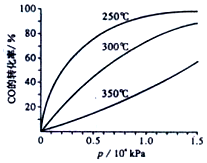 科研生产中常涉及碳的化合物.请回答下列问题:
科研生产中常涉及碳的化合物.请回答下列问题:| 反应时间/min | n[CO(g)]mol | n[H2O(g)]mol |
| 0 | 1.8 | 0.9 |
| t1 | 1.2 | |
| t2 | 0.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com