
分析 (1)加水稀释促进醋酸电离,加入含有醋酸根离子的物质抑制醋酸电离;
(2)相同条件下加水稀释醋酸促进醋酸电离;
(3)等pH的醋酸和盐酸,醋酸的浓度大于盐酸,中和相同浓度的NaOH溶液时,消耗NaOH溶液体积与酸的物质的量成正比;
(4)pH=2的醋酸浓度大于0.01mol/L,PH=12的NaOH溶液浓度为0.01mol/L,二者等体积混合,醋酸过量,导致溶液呈酸性,再结合电荷守恒判断;
(5)醋酸是弱电解质,不能完全电离,而HCl是强电解质,能完全电离.
解答 解:(1)醋酸是弱电解质,加水稀释促进醋酸电离,则电离平衡向向右移动;向醋酸中加入醋酸钠固体,导致溶液中醋酸根离子浓度增大,抑制醋酸电离,溶液中醋酸分子个数增大,氢离子个数减小,所以溶液中$\frac{c({H}^{+})}{c(C{H}_{3}COOH)}$的比值减小,
故答案为:向右;减小;
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍,稀释过程中,醋酸继续电离出氢离子,氯化氢完全电离,导致稀释后的溶液醋酸中氢离子浓度大于盐酸,所以其pH大小关系为:pH(甲)小于pH(乙),故答案为:小于;
(3)中和相同浓度的NaOH溶液时,消耗NaOH溶液体积与酸的物质的量成正比,等pH的醋酸和盐酸,醋酸的浓度大于盐酸,所以等体积等PH的醋酸和盐酸,醋酸的物质的量大于盐酸,则醋酸消耗的NaOH体积大于盐酸,故答案为:大于;
(4)pH=2的醋酸浓度大于0.01mol/L,PH=12的NaOH溶液浓度为0.01mol/L,二者等体积混合,醋酸过量,导致溶液呈酸性,则c(H+)>c(OH-),根据电荷守恒得c(Na+)<c(CH3COO-),故答案为:小于;
(5)醋酸是弱电解质,不能完全电离,而HCl是强电解质,能完全电离,故25mLpH=2的醋酸溶液和pH=2的盐酸中氢离子的物质的量甲>乙,故加入足量的锌后,产生氢气的体积甲大于乙,故答案为:大于.
点评 本题考查了弱电解质的电离,明确弱电解质的电离特点、弱电解质的影响因素等知识点来分析解答,离子浓度大小比较时要明确溶液中的溶质及其性质,再结合电荷守恒来判断,为易错点.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:多选题
| A. |  装置所示装置可实现反应:Cu+2H2O$\frac{\underline{\;通电\;}}{\;}$Cu(OH)2+H2↑ | |
| B. | 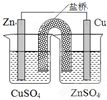 装置能构成锌铜原电池 | |
| C. | 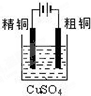 装置可用于粗铜的电解精炼 | |
| D. |  装置可用于在实验室测定中和反应的反应热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
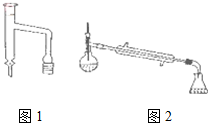 乙酸环己酯具有香蕉及苹果气味,主要用于配制各种饮料、冰淇淋等,实验室制备乙酸环己酯的反应原理、装置示意图和有关数据如下:
乙酸环己酯具有香蕉及苹果气味,主要用于配制各种饮料、冰淇淋等,实验室制备乙酸环己酯的反应原理、装置示意图和有关数据如下: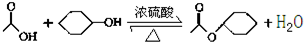
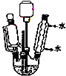 | 相对分子质量 | 密度/g•cm-3 | 沸点 | 水中溶解性 | |
| 乙酸 | 60 | 1.051 | 118.0 | 溶 | |
| 环己醇 | 100 | 0.962 | 160.8 | 微溶 | |
| 乙酸环己酯 | 142 | 0.969 | 173.5 | 难溶 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠能与硫酸铜稀溶液反应,置换出红色的铜 | |
| B. | 为了消除碘缺乏病,在食用盐中必须加入一定量的单质碘 | |
| C. | 过氧化钠是淡黄色固体,可用作呼吸面具的供氧剂 | |
| D. | 氢气在氧气或氯气中燃烧,都能观察到淡蓝色火焰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | Na+、Ba2+、NH4+ |
| 阴离子 | CH3COO-、Cl-、OH-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
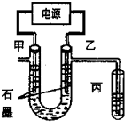 CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu (H2O)42+ (蓝色)+4Cl-?CuCl42- (黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电.下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝.回答下列问题:
CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu (H2O)42+ (蓝色)+4Cl-?CuCl42- (黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电.下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分子式为C3H6O的有机化合物性质相同 | |
| B. | 现在“点石成金”术石墨变成金刚石属于物理变化 | |
| C. | 过氧化钠与水反应成1mol氧气转移4mol电子 | |
| D. | 工业上冶炼铝时加入冰晶石的作用是降低氧化铝的熔融温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
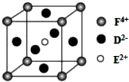 A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域.请回答下列各题(涉及元素请用相应化学符号表示):
A、B、C、D、E、F是前四周期原子序数依次增大的六种元素.A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同,A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1,E元素原子的K、L层电子数之和等于其M、N层电子数之和,F被称为继铁、铝之后的第三金属,可用于制造飞机、火箭、人造卫星、宇宙飞船等领域.请回答下列各题(涉及元素请用相应化学符号表示):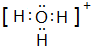 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+、Fe2+、Cl-、SO42- | B. | Na+、K+、Cl-、SO42- | ||
| C. | Mg2+、K+、H+、SO42- | D. | K+、Ca2+、HCO3-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com