Ⅰ、铝是地壳中含量最高的金属元素,其单质及其合金在生产生活中的应用十分广泛.
(1)金属铝的生产是以Al
2O
3为原料,与冰晶石(Na
3AlF
6)在熔融状态下进行电解,则化学方程式为:
.其电极均由石墨材料做成,则电解时不断消耗的电极是
(填“阴极”或“阳极”).
(2)对铝制品进行抗腐蚀处理,可延长其使用寿命.以处理过的铝材为阳极,在H
2SO
4溶液中电解,铝材
表面形成氧化膜,阳极反应式为
.
(3)铝电池性能优越,Al-Ag
2O电池可用作水下动力电源,化学反应为2Al+3Ag
2O+2NaOH+3H
2O═2Na[Al(OH)
4]+6Ag,则负极的电极反应式为
,正极附近溶液的pH
(填“变大”、“不
变”或“变小”).
Ⅱ、氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.
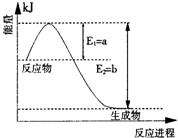
(1)图是在一定温度和压强下N
2和H
2反应生成1molNH
3过程中能量变化示意图,请写出合成氨的热化学反应方程式:
(△H的数值用含字母a、b的代数式表示).
(2)工业合成氨的反应为
N
2(g)+3H
2(g)
2NH
3(g).
在一定温度下,将一定量的N
2和H
2通入到体积为1L的密闭容器中,反应达到平衡后,改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是
.
A.增大压强 B.增大反应物的浓度 C.使用催化剂 D.降低温度
Ⅲ、铁及其化合物在生活、生产中有广泛应用.请回答下列问题:
(1)黄铁矿(FeS
2)是生产硫酸和冶炼钢铁的重要原料.其中一个反应为:
3FeS
2+8O
26SO
2+Fe
3O
4,有3mol FeS
2参加反应,转移
mol电子;
(2)氯化铁溶液称为化学试剂中的“多面手”,写出SO
2通入氯化铁溶液中反应的离子方程式:
.




 一本好题口算题卡系列答案
一本好题口算题卡系列答案