
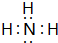 .实验室制取该种物质的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$ 2NH3↑+CaCl2+2H2O.
.实验室制取该种物质的化学方程式为Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$ 2NH3↑+CaCl2+2H2O.分析 短周期的四种元素a、b、c、d、e原子序数依次增大,a的单质最轻,则a为H元素;元素d是地壳中含量最高的金属元素,d为Al元素,a和d的原子序数之和等于b的原子序数的两倍,则b的原子序数为7,故b为N元素;e的质子数是c的两倍且同主族,则c为O元素、e为S元素,据此解答.
解答 解:短周期的四种元素a、b、c、d、e原子序数依次增大,a的单质最轻,则a为H元素;元素d是地壳中含量最高的金属元素,d为Al元素,a和d的原子序数之和等于b的原子序数的两倍,则b的原子序数为7,故b为N元素;e的质子数是c的两倍且同主族,则c为O元素、e为S元素.
(1)d为Al,元素在周期表中的位置:第三周期第ⅢA族,故答案为:第三周期第ⅢA族;
(2)a和b元素组成的四核10电子分子为NH3,电子式为: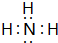 ,实验室制取该种物质的化学方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$ 2NH3↑+CaCl2+2H2O,
,实验室制取该种物质的化学方程式为:Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$ 2NH3↑+CaCl2+2H2O,
故答案为: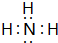 ;Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$ 2NH3↑+CaCl2+2H2O;
;Ca(OH)2+2NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$ 2NH3↑+CaCl2+2H2O;
(3)由a和c两种元素形成的18电子的物质为H2O2,结构式为H-O-O-H,往一定量的氯化亚铁溶液中滴加适量该物质溶液,发生反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:H-O-O-H;2Fe2++H2O2+2H+=2Fe3++2H2O;
(4)由d和e两种元素组成的化合物为Al2S3,投入水中发生反应:2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑,所观察到的现象:产生白色沉淀和气泡,
故答案为:产生白色沉淀和气泡;2Al3++3S2-+6H2O=2Al(OH)3↓+3H2S↑.
点评 本题考查位置结构性质关系应用,侧重对化学用语的考查,难度中等,推断元素是关键,注意基础知识的全面掌握.


科目:高中化学 来源: 题型:选择题
| A. | 该电池工作时,正极反应为2SOCl2+4e-═4Cl-+S+SO2 | |
| B. | 锂电极作该电池负极,负极反应为Li-e-═Li+ | |
| C. | 该电池组装时,必须在无水无氧条件下进行 | |
| D. | 该电池工作时,电子通过外电路从正极流向负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝的表面容易形成致密的氧化膜,抗腐蚀性能好 | |
| B. | 常温下不与碱反应 | |
| C. | 铝元素在地壳中的含量高,储量丰富 | |
| D. | 工业上可以用电解法冶炼铝 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol H2SO4与1 mol Ba(OH)2完全中和所放出的热量为中和热 | |
| B. | 强酸和强碱的稀溶液发生中和反应一定是放热反应,弱酸和弱碱反应一定也是放热反应 | |
| C. | CO是不稳定的氧化物,它能继续和氧气反应生成稳定的CO2,故反应一定是吸热反应 | |
| D. | 酸和碱发生中和反应生成1 mol 水,这时的反应热叫中和热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 小于1nm | B. | 在1nm~100nm间 | C. | 大于100nm | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | Q |
| A. | X、W能与钠形成摩尔质量相同的化合物 | |
| B. | 含X和Z元素的常见化合物为分子晶体 | |
| C. | 最高价氧化物对应的水化物酸性:W>Q | |
| D. | 原子半径大小关系:Q>W>Z>Y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com