
分析 (1)物质A是一种碱式碳酸盐,它与过量的硫酸反应,可得到蓝色溶液,则A中含有+2价的Cu,2.40g物质A加热使其完全分解,得到1.60g金属氧化物的固体为CuO,根据质量守恒计算生成二氧化碳、水的总质量,结合二者质量比计算各自质量,再计算各自物质的量,根据守恒计算2.4gA中Cu2+、OH-、CO32-的物质的量,进而确定化学式;
(2)蓝色溶液为硫酸铜溶液,从溶液增重获得晶体需要经过加热浓缩、冷却结晶、过滤等;
(3)利用电解法精炼铜,粗铜作阳极,纯铜作阴极,阴极上发生还原反应,铜离子在阴极放电析出Cu.
解答 解:(1)物质A是一种碱式碳酸盐,它与过量的硫酸反应,可得到蓝色溶液,则A中含有+2价的Cu,2.40g物质A加热使其完全分解,得到1.60g金属氧化物的固体为CuO,则n(CuO)=$\frac{1.60g}{80g/mol}$=0.02mol,
根据质量守恒,生成二氧化碳、水的总质量为2.4g-1.6g=0.8g,由于m(CO2):m(H2O)=11:9,则m(CO2)=0.8g×$\frac{11}{11+9}$=0.44g,m(H2O)=0.8g-0.44g=0.36g,则n(CO2)=$\frac{0.44g}{44g/mol}$=0.01mol,n(H2O)=$\frac{0.36g}{18g/mol}$=0.02mol,
则A中n(Cu2+):n(OH-):n(CO32-)=n(CuO):2n(H2O):n(CO2)=0.02mol:2×0.01mol:0.01mol=2:2:1,故A的化学式为Cu2(OH)2CO3,
故答案为:Cu2(OH)2CO3;
(2)蓝色溶液为硫酸铜溶液,经过加热浓缩、冷却结晶、过滤等得到硫酸铜晶体,
故答案为:加热浓缩、冷却结晶;
(3)利用电解法精炼铜,粗铜作阳极,纯铜作阴极,阴极上发生还原反应,铜离子在阴极放电析出Cu,阴极电极反应式:Cu2++2e-=Cu,
故答案为:Cu2++2e-=Cu.
点评 本题考查物质组成确定、实验基本操作、电解原理应用等,侧重考查学生分析计算能力,题目比较综合,基本属于拼合型题目,需要学生具备扎实的基础与灵活运用能力.


科目:高中化学 来源: 题型:选择题
| A. | 分别用H2O2、KMnO4分解制O2,当制得等质量O2时,转移电子数之比为1:2 | |
| B. | 等质量的O2与O3中,氧原子的个数比为3:2 | |
| C. | CaCl2及CaO2固体中阴、阳离子数之比均为2:1 | |
| D. | 10mL 0.3mol/LNaCl与30mL0.1mol/LAlCl3溶液中Cl-物质的量浓度比为1:3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
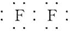 .
.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | ${\;}_{8}^{18}$O,${\;}_{8}^{17}$O | B. | O2,O3 | C. | Fe3+,Fe2+ | D. | ${\;}_{6}^{12}$C,${\;}_{6}^{13}$C |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③⑤⑧ | B. | ①④⑥ | C. | ①③⑤⑧ | D. | ②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
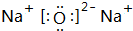 、
、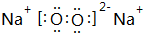 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CH═CHCH2CH3 | B. | CH2═CHCH2CH2CH3 | ||
| C. | CH3CH═CHCH2CH2CH3 | D. | 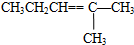 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com