
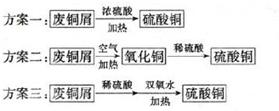


科目:高中化学 来源:不详 题型:填空题
 2Cl2+2H2O,可实现氯的循环利用。
2Cl2+2H2O,可实现氯的循环利用。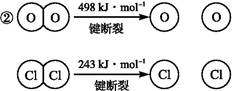
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
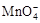 氧化C2O42?的离子方程式补充完整:
氧化C2O42?的离子方程式补充完整:| 滴入KMnO4溶液的次序 | KMnO4溶液紫色褪去所需的时间 |
| 先滴入第1滴 | 60 s |
| 褪色后,再滴入第2滴 | 15 s |
| 褪色后,再滴入第3滴 | 3 s |
| 褪色后,再滴入第4滴 | 1 s |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.H+、NO3-、Fe2+、Na+四种离子在溶液中能够大量共存 |
| B.Cl2通入水中的离子方程式:Cl2+H2O=2H++Cl-+ClO- |
| C.1mol Na2O2中含有2mol阳离子和1mol阴离子 |
| D.向某溶液中加入澄清石灰水变浑浊,再加入盐酸,变澄清且有无色无味气体产生,则原溶液中一定含有碳酸根离子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
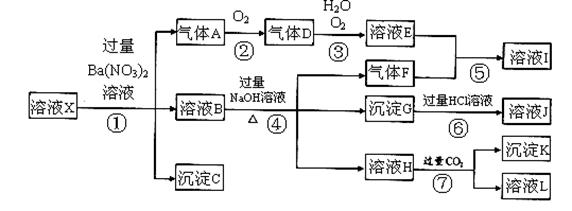
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
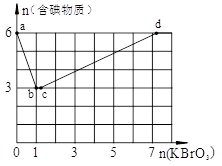
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 Cu (HDZ)2+2H+,再加入CCl4、Cu (HDZ)2就很容易被萃取到CCl4中。
Cu (HDZ)2+2H+,再加入CCl4、Cu (HDZ)2就很容易被萃取到CCl4中。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.向Ca(OH)2溶液中通入过量的CO2 | B.向NaAlO2溶液中滴入过量的盐酸 |
| C.向氯化铝溶液中滴加过量的氨水 | D.向Al2(SO4)3溶液中滴入过量的NaOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com