
【题目】黄铁矾法是硫酸体系中除铁的常用方法,黄铵铁矾是黄铁矾中的一种[化学式可表示为(NH4)xFey(SO4)z(OH)w,摩尔质量为480 g·mol-1]。
(1) 除去MnSO4酸性溶液中的Fe2+可向溶液中加入MnO2,充分搅拌,然后用氨水调节溶液的pH为1~3,升温到95 ℃,静置即可形成黄铵铁矾沉淀。MnO2氧化Fe2+的离子方程式为_______________________,静置形成黄铵铁矾过程中溶液的pH________(填“增大”“减小”或“不变”)。
(2) 依据下列实验和数据可确定黄铵铁矾的化学式。
①称取黄铵铁矾2.400 g,加入足量NaOH溶液充分反应后过滤,向滤液中加入足量盐酸酸化的BaCl2溶液,得到沉淀2.330 g。
②Mim Ristic等曾对黄铵铁矾进行热分解实验,其结果可用下图热重曲线表示(已知:黄铵铁矾在300 ℃前分解释放的物质为H2O,300~575 ℃之间只有NH3·H2O放出,此时残留固体只存在Fe、O、S三种元素,670 ℃以上得到的是纯净的红棕色粉末)。
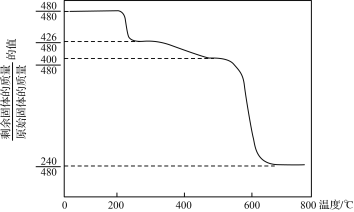
根据以上实验及图中数据确定黄铵铁矾的化学式______________(写出计算过程)。
【答案】MnO2+4H++2Fe2+===Mn2++2Fe3++2H2O 减小 由z= =2
=2
y=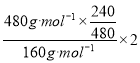 =3
=3
18 g·mol-1×x+56 g·mol-1×3+96 g·mol-1×2+17 g·mol-1×w=480 g·mol-1
由化合价代数和为0∶x×(+1)+3×(+3)+2×(-2)+w×(-1)=0
解得:x=1,w=6
[或![]() ,减少的必为NH3和H2O,即每480 g黄铵铁矾受热分解,此阶段中释放1 mol NH3和0.5 mol H2O,推得x=1
,减少的必为NH3和H2O,即每480 g黄铵铁矾受热分解,此阶段中释放1 mol NH3和0.5 mol H2O,推得x=1
由电荷守恒:x+3y=2z+w,w=6]
化学式为NH4Fe3(SO4)2(OH)6
【解析】
(1) MnO2氧化Fe2+生成Fe3+和Mn2+, 离子方程式为 MnO2+4H++2Fe2+===Mn2++2Fe3++2H2O,静置形成黄铵铁矾过程中消耗OH-,溶液的pH减小;
(2) 由z= =2
=2
y=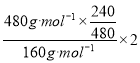 =3
=3
18 g·mol-1×x+56 g·mol-1×3+96 g·mol-1×2+17 g·mol-1×w=480 g·mol-1
由化合价代数和为0∶x×(+1)+3×(+3)+2×(-2)+w×(-1)=0
解得:x=1,w=6
[或![]() ,减少的必为NH3和H2O,即每480 g黄铵铁矾受热分解,此阶段中释放1 mol NH3和0.5 mol H2O,推得x=1
,减少的必为NH3和H2O,即每480 g黄铵铁矾受热分解,此阶段中释放1 mol NH3和0.5 mol H2O,推得x=1
由电荷守恒:x+3y=2z+w,w=6]
化学式为NH4Fe3(SO4)2(OH)6


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】某同学按照课本实验要求,用 50mL 0.50 mol·L-1 的盐酸与 50mL 0.50 mol·L-1 的NaOH溶液在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量计算反应热。下列 说法中,不正确的是( )
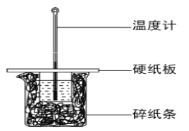
A.实验过程中有一定的热量损失
B.图中实验装置缺少环形玻璃搅拌棒
C.烧杯间填满碎纸条的主要作用是固定小烧杯
D.若将盐酸体积改为 60 mL,理论上所求反应热相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素 a~g 在表中的位置如右表,请回答下列问题:

(1)d、e元素常见离子的半径由大到小的顺序为(用化学式表示)__________;b、c两元素非金属性较强的是(写元素符号)_________,写出能证明这一结论的一个化学方程式_____________。
(2)下列有关说法正确的是(___)
A.e在 d2 中燃烧,生成e2d
B.加热熔化eda时不可用Al2O3坩埚,可用瓷坩埚
C.将 gd2 通入溴水中,溴水褪色,体现了gd2 的漂白性
D.将打磨过的 f 置于酒精灯上点燃,观察到f 熔化但未见液滴滴落
(3)上述元素可组成盐 R:ca4f(gd4)2和盐S:ca4agd4。
①相同条件下,0.1 mol·L-1盐R中 c(ca4+) _______(填“=”、 “>”或“<”)0.1 mol·L-1盐S中c(ca4+)。
②R常用作净水剂,其原理为(用离子方程式表示)______________。
③向盛有 10 mL 1 mol·L-1盐S溶液的烧杯中滴加1 mol·L-1 NaOH溶液至中性,则反应后各离子浓度由大到小的排列顺序是_____________。
④向盛有 10 mL 1 mol·L-1盐R溶液的烧杯中滴加 1 mol·L-1NaOH溶液 32 mL后,继续滴加至35 mL,写出此时段(32 mL~35 mL)间发生的离子方程式:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】药物瑞德西韦(Remdesivir)对新冠病毒有明显抑制作用,化合物 M是合成瑞德西韦的中间体,下列关于M的说法错误的是
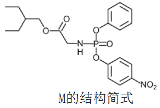
A.核磁共振氢谱共有11个吸收峰
B.分子中含有3种含氧官能团
C.分子中N原子一个是sp2杂化,一个是sp3杂化
D.1mol该物质与足量NaOH溶液反应时消耗3molNaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某气态烷烃和某气态单烯烃(只含一个碳碳双键)组成的混合气体在同温、同压下是氢气密度的13倍,取标准状况下此混合气体4.48L,通入足量溴水中,溴水质量增加2.8g,则此混合气体可能是( )
A.甲烷和丙烯B.乙烷和丙烯
C.甲烷和2-甲基丙烯D.乙烷和1-丁烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组学生利用装置用![]() 盐酸滴定未知浓度的NaOH溶液,并用酚酞作为指示剂
盐酸滴定未知浓度的NaOH溶液,并用酚酞作为指示剂
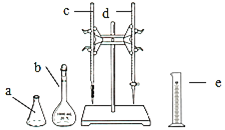
(1)量取![]() 待测NaOH溶液时,用到的测量仪器是 ______
待测NaOH溶液时,用到的测量仪器是 ______ ![]() 填仪器标号
填仪器标号![]() .
.
(2)仪器![]() 中,需要用待装液润洗的有 ______
中,需要用待装液润洗的有 ______ ![]() 填字母
填字母![]()
(3)该滴定实验过程中,判定滴定终点的依据是 ______
(4)该实验小组重复三次的实验数据如下表所示,计算NaOH溶液的浓度为 ______
实验序号 | 盐酸体积 | NaOH溶液体积 |
1 |
|
|
2 |
|
|
3 |
|
|
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关有机物的说法中
①结构片段为…… ……的高聚物,其单体是甲醛和苯酚
……的高聚物,其单体是甲醛和苯酚
②标准状况下,22.4LHF所含电子数约为10NA
③甲醇通常是一种有毒的气体,分子中只含极性键
④苯酚和碳酸钠溶液的反应:![]()
⑤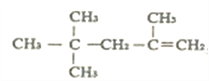 的名称为:2,4,4,-三甲基-1-戊烯
的名称为:2,4,4,-三甲基-1-戊烯
⑥3-甲基-1-丁烯中的所有碳原子不可能处于同一平面
⑦等物质的量的苯与苯甲酸完全燃烧消耗氧气的量不相等
其中正确的有 个。
A. 4 B. 5 C. 6 D. 7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、SO2是主要的大气污染气体,利用化学反应原理是治理污染的重要方法。
I.甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产。工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)![]() CH3OH(g) △H1=-116kJ·mol-1
CH3OH(g) △H1=-116kJ·mol-1
(1)下列措施中有利于增大该反应的反应速率的是___;
A.随时将CH3OH与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
(2)已知:CO(g)+2H2(g)![]() CH3OH(g) △H1=-116kJ·mol-1
CH3OH(g) △H1=-116kJ·mol-1
CO(g)+![]() O2(g)=CO2(g) △H2=-283kJ·mol-1
O2(g)=CO2(g) △H2=-283kJ·mol-1
H2(g)+![]() O2(g)=H2O(g) △H3
O2(g)=H2O(g) △H3
化学键 | H—H | O=O | O—H |
键能/KJmol-1 | 436 | 498 | 463.5 |
则△H3=___,表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为___;
Ⅱ.当温度高于500 K时,科学家成功利用二氧化碳和氢气合成了乙醇,2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g)。这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
C2H5OH(g)+3H2O(g)。这在节能减排、降低碳排放方面具有重大意义。回答下列问题:
(1)其平衡常数表达式为K=____。
(2)在恒容密闭容器中,判断上述反应达到平衡状态的依据是___。
a.体系压强不再改变 b.H2的浓度不再改变
c.气体的密度不随时间改变 d.单位时间内消耗H2和CO2的物质的量之比为3∶1
(3)在一定压强下,测得由CO2制取CH3CH2OH的实验数据中,起始投料比、温度与CO2的转化率的关系如图。根据图中数据
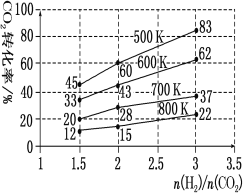
①降低温度,平衡向____方向移动。
②在700K、起始投料比![]() =1.5时,H2的转化率为___。
=1.5时,H2的转化率为___。
③在500K、起始投料比![]() =2时,达到平衡后H2的浓度为amol·L-1,则达到平衡时CH
=2时,达到平衡后H2的浓度为amol·L-1,则达到平衡时CH
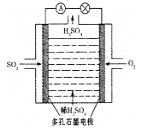
Ⅲ.某学习小组以SO2为原料,采用原电池法制取硫酸。该小组设计的原电池原理如图所示。该电池中右侧为___极,写出该电池负极的电极反应式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为![]() 价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中错误的是( )
价。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元),则下列说法中错误的是( )

A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2-
B.晶体中,每个O2-周围距离最近的O2-有8个
C.晶体中与每个K+周围有8个O2-
D.晶体中,0价氧与-2价氧的数目比为3∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com