
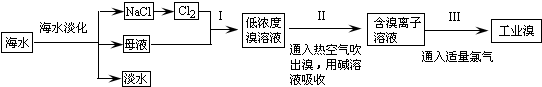
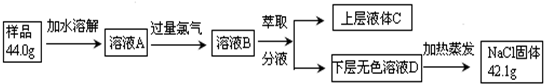
分析 海水经淡化后母液中含有溴离子,通入氯气,可得到低浓度的溴,然后通入空气吹出,进行富集,用碱溶液吸收,再通入氯气可得到浓度较大的溴.
(1)电解饱和氯化钠溶液,在阳极上产生氯气,阴极上产生氢气,同时生成了氢氧化钠;
(2)海水淡化得到的母液和电解氯化钠溶液生成的氯气反应,得到的溴单质浓度低,溴单质在水中有一定的溶解性且和水反应,提取时消耗过的能源和原料,降低了经济效益;
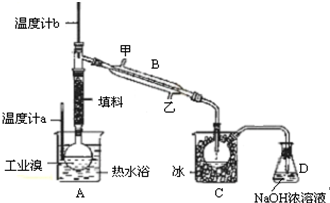
(3)①蒸馏时,为充分冷凝,冷凝水应从下端进,上端出;
②因溴具有强氧化性和腐蚀性,应避免使用橡皮管;
③控制温度计b的温度,并收集59℃的馏分;
④溴单质颜色为红棕色;
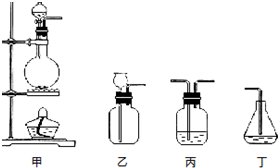
(4)若食盐样品中混有NaBr杂质,加水溶解后通入氯气,经萃取分液后得到氯化钠溶液和溴的四氯化碳溶液,对氯化钠溶液进行蒸发结晶,得到氯化钠固体,根据氯化钠和样品的质量,可得到该食盐样品的纯度,实验室用浓盐酸和二氧化锰在加热条件下反应生成氯气,饱和食盐水除去氯化氢,用丙进行除杂;
氯气的制取选用二氧化锰和浓盐酸,饱和食盐水除去氯化氢,过量的氯气用氢氧化钠除去,通气体选用丙装置;
(5)设样品中溴化钠的质量为xg,
2NaBr+Cl2=2NaCl+Br2 △m
206 117 89
x 44-42.1=1.9
计算得到溴化钠质量,得到样品纯度.
解答 解:(1)电解饱和氯化钠溶液,在阳极上产生氯气,阴极上产生氢气,同时生成了氢氧化钠,即H2、NaOH,故答案为:H2、NaOH;
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,目的是低浓度的Br2溶液在提取时消耗过多的原料和能源,转化为HBr后易被氧化剂氯气氧化为溴单质,用于富集溴元素,
故答案为:提高溴的富集程度;
(3)①由装置图可知,提纯溴利用的原理是蒸馏,仪器B为冷凝管,
故答案为:冷凝管;
②溴单质是一种强氧化剂,易腐蚀橡胶制品,所以整套装置不能用橡胶塞和橡胶管,
故答案为:Br2腐蚀橡胶;
③实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件是:控制温度计b的温度,并收集59℃的馏分,
故答案为:控制温度计b的温度,并收集59℃的馏分;
④控制温度59℃,使溴单质挥发,通过冷凝得到呈深红棕色或红棕色的液态溴单质,
故答案为:深棕红色或红棕色;
(4)若食盐样品中混有NaBr杂质,加水溶解后通入氯气,经萃取分液后得到氯化钠溶液和溴的四氯化碳溶液,对氯化钠溶液进行蒸发结晶,得到氯化钠固体,根据氯化钠和样品的质量,可得到该食盐样品的纯度,该实验方法为定量法中的重量法,实验室用浓盐酸和二氧化锰在加热条件下反应生成氯气,用丙除去氯化氢,然后在丙中反应,尾气也可用丙处理,氯气的制取选用二氧化锰和浓盐酸,故选用甲装置,饱和食盐水除去氯化氢,通气体A溶液中选用丙装置,过量的氯气用丙装置中的氢氧化钠除去,
故答案为: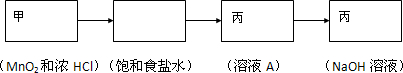 ;
;
(5)设样品中溴化钠的质量为xg,
2NaBr+Cl2=2NaCl+Br2 △m
206 117 89
x 44-42.1=1.9
$\frac{206}{x}$=$\frac{89}{1.9}$
x=4.4,故原固体混合物中氯化钠的质量分数为$\frac{44.0-4.4}{44.0}$×100%=90.0%,
故答案为:90.0%.
点评 本题考查物质的分离、提纯,侧重海水资源的综合利用,涉及到电解、海水提溴工艺等知识点,注意物质的分离、提纯应把握物质的性质的异同,掌握从海水中提取溴的原理为解答该题的关键,题目难度中等.


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:解答题
 按要求填空:
按要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室配制250mL 0.100mol/L氯化钠溶液:
实验室配制250mL 0.100mol/L氯化钠溶液:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 丙烷分子中3个碳原子一定在同一条直线上 | |
| B. | 丙烯分子中3个碳原子都在同一平面 | |
| C. | 乙烷分子中碳原子和全部氢原子可能在同一平面上 | |
| D. | 2-丁烯分子中4个碳原子在同一平面上 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
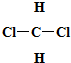 和
和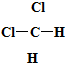 ⑥CH3CH2CH2CH3和
⑥CH3CH2CH2CH3和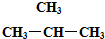
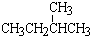 ;
; ③
③ .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:F>CI>Br | B. | 最外层电子数都相同 | ||
| C. | 核外电子层数都相同 | D. | 最外层电子数都不相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把煤块变成煤粉燃烧更为剧烈 | |
| B. | 锌与稀硫酸反应制H2时加入少量CuSO4溶液而使反应速率加快 | |
| C. | 固态FeCl3和固态NaOH混合后,加入水能迅速产生沉淀 | |
| D. | 双氧水中加入少量MnO2,即可迅速放出气体 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com