
某温度时,AgCl(s) 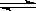 Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
Ag+(aq)+Cl-(aq)在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是
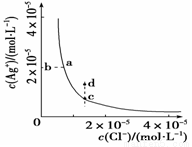
A.加入AgNO3,可以使溶液由c点变到d点
B.加入少量水,平衡右移,Cl-浓度减小
C.d点没有AgCl沉淀生成
D.c点对应的Ksp等于a点对应的Ksp
科目:高中化学 来源:2015-2016学年江苏省高一上期中测试化学试卷(解析版) 题型:选择题
下列实验操作中正确的是
A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B.蒸馏时,温度计水银球靠近蒸馏烧瓶的底部
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.检验溶液中是否含有NH4+:取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体
查看答案和解析>>
科目:高中化学 来源:2016届河南省林州市高三上学期9月质检化学试卷(解析版) 题型:选择题
氨基酸分子之间通过氨基与羧基间的取代反应可生成多肽与水,现有两种氨基酸间的反应为:
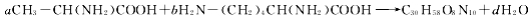 ,则a:b等于
,则a:b等于
A.4:3 B.2:3 C.3:2 D.3:4
查看答案和解析>>
科目:高中化学 来源:2016届吉林省长春市高三上学期质量监测化学试卷(解析版) 题型:推断题
[化学—选修(五)有机化学基础](15分)
苯酚是一种重要的化工原料。以苯酚为主要起始原料,某种药物中间体的合成路线如下:

已知:
(1)C中含氧官能团的名称为 ;
(2)反应I的反应类型是 ;
(3)反应Ⅱ的化学方程式为 ;
(4)化合物B的名称是 ,E的结构简式为 ;
(5)写出满足下列条件的F的同分异构体的结构简式 (任写两种)。
①苯环上有三个取代基且苯环上的一氯取代物只有两种
②能与FeCl3溶液发生显色反应
③红外光谱显示有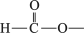
查看答案和解析>>
科目:高中化学 来源:2016届河南省高三上学期10月联考化学试卷(解析版) 题型:选择题
分类法是学习化学的重要方法,人们在认识事物时可采用多种分类方法。下列(2)中的物质不能按照对应的分类标准与(1)中的物质归为一类的是
选项 | (1) | (2) | 分类标准 |
A | 盐酸、漂白粉、水玻璃、双氧水 | 氯水 | 混合物 |
B | CH3COOH、H2CO3、HClO、NH3·H2O | HF | 弱电解质 |
C | 原电池反应、盐的水解、煤的干馏、石油裂解 | 钢铁生锈 | 化学变化 |
D | CO2、SO3、P2O5、SiO2 | Al2O3 | 酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上学期第一次月考化学试卷(解析版) 题型:选择题
下列式子表示的物质一定为纯净物的是
A.C2H6 B.C4H10 C.C5H12 D.C7H16
查看答案和解析>>
科目:高中化学 来源:2016届浙江省温州市高三上学期返校联考化学试卷(解析版) 题型:填空题
(14分) 二氧化碳与氢气催化合成甲醇,发生的反应为:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
(1)已知:
化学键 | H-H | C-O | C=O | H-O | C-H |
键能/kJ·mol-1 | 436 | 326 | 803 | 464 | 414 |
计算上述反应的△H= kJ.mol-1。
(2)一定条件下,将n(CO2):n(H2)=1:1的混合气充入恒温恒容密闭容器中,下列事实可以说明该反应已达平衡的是 (填选项字母)。
A.容器内气体密度保持不变
B.CO2的体积分数保持不变
C.H2O(g)与CO2(g)的生成速率之比为1∶1
D.该反应的平衡常数保持不变
E.混合气体的平均相对分子质量不变
F.容器中压强保持不变
(3)一定条件下,往2L恒容密闭容器中充入1.2molCO2和3.6molH2,在不同催化剂作用下的反应I、反应II与反应III,相同时间内CO2转化率随温度变化的数据如表所示,据表中数据绘制“图1”:
相同时间内CO2转化率 | T1 | T2 | T3 | T4 | T5 |
反应Ⅰ | 65% | 77% | 80% | 80% | 66.67% |
反应Ⅱ | 56% | 67% | 76% | 80% | 66.67% |
反应Ⅲ | 48% | 62% | 72% | 80% | 66.67% |
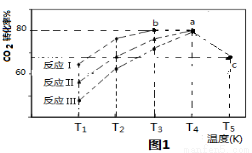
(T5时,图1中C点转化率为66.67%,即转化了2/3)
①催化剂效果最佳的反应是 (填“反应I”,“反应II”,“反应III”)。
②T3的b点v(正) v(逆)(填 “>”, “<”, “=” )。
③T4的a点转化率比T5 的c点高的原因是 。
④在温度为T5时,该反应的平衡常数K= 。
⑤在温度为T5时,CH3OH的浓度随时间变化的趋势如“图2”所示。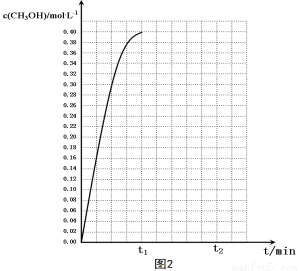
当时间到达t1时,将生成的甲醇和水同时除去,并维持该温度,在 t2时达新平衡。
请在“图2”中画出t1时刻后CH3OH的浓度变化总趋势曲线。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二上学期第二次月考化学试卷(解析版) 题型:简答题
(6分)氢能是一种极具发展潜力的清洁能源。以太阳能为热源,热化学硫碘循环分解水是一种高效、无污染的制氢方法。其反应过程如下图所示:

反应Ⅱ:2H2SO4(l)=2SO2(g)+O2(g)+2H2O(g) △H=+550 kJ·mol-1
它由两步反应组成:i.H2SO4(l)=SO3(g)+H2O(g) △H=+177 kJ·mol-1
ii.SO3(g)分解。
L(L1、L2)、X可分别代表压强和温度。下图表示L一定时,ii中SO3(g)的平衡转化率随X的变化关系。

①X代表的物理量是 。
②判断L1、L2的大小关系,L1 L2
并简述理由: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com