
| A. | 氧化性:B2>C2>A2 | |
| B. | 在含有C-和A-的溶液中加入B2,C-优先发生反应 | |
| C. | 还原性:A->C->B- | |
| D. | 在含有B2和C2的溶液中加入A-,B2优先发生反应 |
分析 氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性;还原剂的还原性大于还原产物的还原性;氧化性强的单质可以将氧化性弱的单质从盐溶液中置换出来.
解答 解:A.氧化还原反应中,氧化剂的氧化性大于氧化产物的氧化性,在反应2A-+C2═2C-+A2中,氧化剂是C2,氧化产物是A2,所以氧化性C2>A2,在反应2C-+B2═2B-+C2中,氧化剂是B2,氧化产物是C2,所以氧化性B2>C2,故氧化性顺序是:B2>C2>A2,故A正确;
B.由选项A可知,氧化性顺序是:B2>C2>A2,则还原性为A->C-,在含有C-和A-的溶液中加入B2,A-优先发生反应,故B错误;
C.由选项A可知,氧化性顺序是:B2>C2>A2,则还原性为A->C->B-,故C正确;
D.氧化性B2>C2,在含有B2和C2的溶液中加入A-,B2优先发生反应,故D正确.
故选B.
点评 本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及氧化性、还原性比较的考查,题目难度不大.


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:选择题
| A. | 只有②③④ | B. | 只有③⑤ | C. | 只有①④⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,名称是:3-甲基-1-丁炔.
,名称是:3-甲基-1-丁炔.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
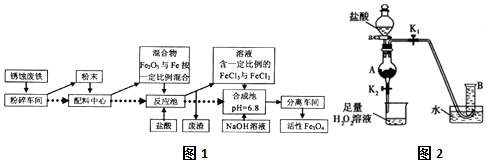
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 可逆反应是指在同一条件下能同 时向正逆两个方向进行的反应 | |
| B. | 2HI$\stackrel{△}{?}$H2+I2是可逆反应 | |
| C. | 2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O与2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑互为可逆反应 | |
| D. | 只有可逆反应才存在化学平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2L0.5mol/L Na2SO4溶液中含NA个Na+ | |
| B. | 在常温常压下,1molHe含有的原子数为2NA | |
| C. | 2gH2所含原子数为NA | |
| D. | 在常温常压下,11.2L氮气含有的分子数小于0.5NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com