
(10分)
以天然气为原料经由合成气(CO 、H2)制化学品是目前天然气转化利用的主导技术路线,主要工艺有以下几种:
(1)甲烷的部分氧化。其反应式如下:
 CH4(g) + 1/2O2 (g)=CO (g) + 2H2(g);ΔH =-35.6 kJ·mol-1。
CH4(g) + 1/2O2 (g)=CO (g) + 2H2(g);ΔH =-35.6 kJ·mol-1。
则该反应的ΔS ▲ 0(填“>”、“<”或“=”)。
有研究认为甲烷部分氧化的机理为:
① CH4(g) + 2O2 (g) =CO 2(g) + 2H2O(g);ΔH1=-890.3 kJ·mol-1
② CH4(g) + CO2 (g) = 2CO (g) + 2H2(g);ΔH2=247.3 kJ·mol-1
③ CH4(g) + H2O (g) = CO (g) + 3H2(g);ΔH3= ▲ kJ·mol-1
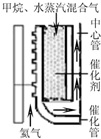
(2)甲烷水蒸汽催化重整。如右上图所示热氦气从下部流入提供能量。由甲烷和水蒸汽混合气从催化管的上部流入,从下端出来后再向上进入中心管。根据下表数据计算甲烷的转化率为 ▲ 。
| 气体 | 进口温度/℃ | 进口压强/MPa | 进口流量/g·s―1 | 出口流量/ g·s―1 |
| 甲烷 | 464 | 4.26 | 12 | 5.4 |
(3)甲烷二氧化碳催化重整。高温下,该反应速率明显降低的原因可能是 ▲ 。
(4)甲烷的部分氧化与重整耦合。以天然气为燃料的发电尾气(主要含CO2、H2O、O2 和N2)与甲烷可直接用于制合成气。下列说法错误的是 ▲ (填序号)。
A.直接利用烟气中的CO2,可以大规模地减少 CO2的排放量
B.发电尾气的出口温度较高,可以利用以节约能量
C.使用恰当的催化剂可以增大甲烷的转化率
D.因发电尾气反应中包含甲烷燃烧,可实现部分热量自供,可降低成本
 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 (2010?江苏二模)以天然气为原料经由合成气(CO、H2)制化学品是目前天然气转化利用的主导技术路线,主要工艺有以下几种:
(2010?江苏二模)以天然气为原料经由合成气(CO、H2)制化学品是目前天然气转化利用的主导技术路线,主要工艺有以下几种:| 1 |
| 2 |
| 气体 | 进口温度/℃ | 进口压强/MPa | 进口流量/g?s-1 | 出口流量/g?s-1 |
| 甲烷 | 464 | 4.26 | 12 | 5.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
(12分)随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气为原料经由合成气(CO 、H2)制化学品是目前天然气转化利用的主导技术路线,主要工艺有以下几种:
(1)甲烷的部分氧化。CH4(g) + 1/2O2 (g) = CO (g) + 2H2(g) ,△H = —35.6 kJ/mol。该反应是 ▲ 反应(填“自发”、“非自发”或“一定条件下自发”)。有研究认为甲烷部分氧化的机理为:
①CH4(g) + 2O2 (g) = CO 2(g) + 2H2O(g) ,△H1 =—890.3 kJ/mol
②CH4(g) + CO2 (g) = 2CO (g) + 2H2(g) ,△H2 = 247.3 kJ/mol
③CH4(g) + H2O (g) = CO (g) + 3H2(g) ,△H3

 反应③的△H3= ▲ 。
反应③的△H3= ▲ 。
(2)甲烷水蒸汽催化重整。如图,反应时热氦气从下部流入提供能量。由甲烷和水蒸汽组成的混合气从催化管的上部流入,发生吸热反应,混合气从下端出来后再向上进入中心管,其目的是 ▲ 。根据下表数据计算甲烷
的转化率为 ▲ 。
| 气体 | 进口温度/℃ | 进口压强/MPa | 进口流量/g.s-1 | 出口流量/g.s-1 |
| 甲烷 | 464 | 4.26 | 12 | 5.4 |
(3)甲烷二氧化碳催化重整。高温下,该反应速率明显降低的原因可能是 ▲ 。
(4)甲烷的部分氧化与重整耦合。以天然气为燃料的发电尾气(主要含CO2、H2O、O2 和N2)与甲烷可直接用于制合成气,下列说法错误的是 ▲ 。(填字母序号)
A.直接利用烟气中的CO2,可以大规模地减少 CO2的排放量
B.烟气的出口温度较高,可以显著地节约能量
C.使用恰当的催化剂可以增大甲烷的转化率
D.由于反应体系中包含甲烷燃烧,可实现部分热量自供,降低成本
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com