
| A. | 硫化钠水解 S2-+2H2O?H2S+2OH- | |
| B. | 硫氢化钠的水解 HS-+H2O?H3O++S2- | |
| C. | 制Fe(OH)3胶体 Fe3++3H2O?Fe(OH)3↓+3H+ | |
| D. | 硫酸铝溶液跟偏铝酸钠溶液反应 Al3++3AlO2-+6H2O═4Al(OH)3↓ |
分析 A.硫离子的水解分步进行,且以第一步为主,其水解的离子方程式只写出第一步即可;
B.硫氢化钠溶液生成硫化氢和氢氧化钠,溶液呈碱性;
C.生成的是氢氧化铁胶体,不能使用沉淀符号,且应该用等号、加热符号;
D.铝离子与偏铝酸根离子发生双水解反应生成氢氧化铝沉淀.
解答 解:A.硫化钠水解分步进行,主要以第一步为主,正确的离子方程式为:S2-+H2O?HS-+OH-,故A错误;
B. HS-+H2O?H3O++S2-为电离方程式,硫氢化钠水解的离子方程式为:HS-+H2O?H2S+OH-,故B错误;
C.铁离子在沸水中水解生成Fe(OH)3胶体,正确的离子方程式为:Fe3++3H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe(OH)3(胶体)+3H+,故C错误;
D.硫酸铝溶液跟偏铝酸钠溶液反应生成氢氧化铝沉淀,反应的离子方程式为:Al3++3AlO2-+6H2O═4Al(OH)3↓,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为高考的高频题,属于中等难度的试题,注意掌握离子方程式的书写原则,明确电离与水解的区别为解答关键,试题侧重基础知识的考查,培养了学生的分析能力及灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 ;
;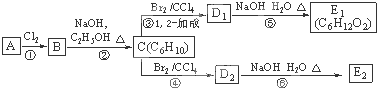
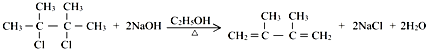 ;
; +Br2→
+Br2→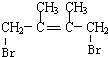 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
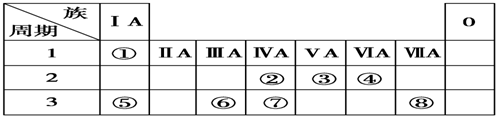
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
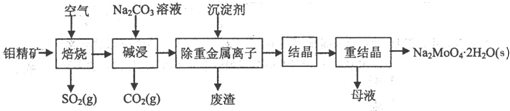

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com