
【题目】水是宝贵的自然资源,水的净化与污水处理是化学工作者需要研究的重要课题。
(1)在净水过程中用到混凝剂,其中不可以作为混凝剂使用的是__________。
A.硫酸铝 B.氧化铝 C.碱式氯化铝 D.氯化铁
(2)海水淡化是人类获得饮用水的一个重要方法,下列有关海水淡化处理的方法正确的是_____。
A.蒸馏法能耗最小,设备最简单;冷冻法要消耗大量能源
B.利用电渗析法淡化海水时,在阴极附近放阴离子交换膜,在阳极附近放阳离子交换膜
C.利用电渗析法淡化海水时,得到淡水的部分在中间区
D.利用反渗透技术可以大量、快速地生产淡水
(3)除了水资源,能源、信息、材料一起构成了现代文明的三大支柱。甲醇是一种重要的化工原料,以甲醇、氧气为基本反应物的新型燃料电池已经问世,其结构如图所示(甲醇解离产生的H+可以通过质子交换膜进入另一极)。请写出通入甲醇的电极上的电极反应式:____________。

某同学以甲醇燃料电池为电源,以石墨为电极电解500mL 0.2mol·L1 CuSO4溶液,则与电源正极相连的电解池电极上的电极反应式为:_______________________________;电解一段时间后,在电解池两极上共产生7.84 L气体(标准状况下),此时甲醇燃料电池中共消耗甲醇_________g 。
【答案】 B C、D CH3OH+H2O-6e―=CO2+6H+ 4OH--4e―=2H2O+O2 3.2
【解析】本题考查净化水的原因以及电极反应式的书写,(1)净水过程是水解产生胶体,氧化铝是难溶于水的物质,氧化铝不水解,故B正确;(2)A、蒸馏法可以利用太阳能使水蒸发,耗能小,设备简单,冷冻法能耗相对较小,故A错误;B、电解时,阴离子在阳极上放电,阳离子在阴极上放电,故B错误;C、利用电渗析法得到淡水,淡水的部分在中间区,故C正确;D、利用反渗透法淡化海水,可以大量快速地生产淡水,故D正确;(3)根据此电池的结构,通甲醇的一极为负极,失去电子,电极反应式为 CH3OH+H2O-6e―=CO2+6H+ ;与电源的正极相连的一极为阳极,因此电极反应式4OH--4e-=2H2O+O2↑;两极共得到7.84L的气体,阴极反应式为:Cu2++2e-=Cu、2H++2e-=H2↑,阳极反应式为4OH--4e-=O2↑+2H2O、4OH--4e-=O2↑+2H2O,设生成氢气的物质的量为xmol,因此有:x+0.2/4+2x/4=7.84/22.4,解得x=0.2mol,电解过程中共转移0.6mol电子,依据甲醇的电极反应式,消耗甲醇的质量为0.6×32/6g=3.2g。


 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
⑴ Y在元素周期表中的位置为____________。
⑵ 上述元素的最高价氧化物对应的水化物酸性最强的是____________(写化学式),非金属气态氢化物还原性最强的是__________________(写化学式)。
⑶ Y、G的单质或两元素之间形成的化合物可作水消毒剂的有___________(写出其中两种物质的化学式)。
⑷ X2M的燃烧热ΔH = -a kJ·mol-1 ,写出X2M燃烧反应的热化学方程式:
____________________________________________________________ 。
⑸ ZX的电子式为___________;ZX与水反应放出气体的化学方程式为___________________________。
⑹ 熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:
2Z + FeG2 ![]() Fe + 2ZG
Fe + 2ZG

放电时,电池的正极反应式为_______________;充电时,_______(写物质名称)电极接电源的负极;该电池的电解质为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置进行实验,将液体a逐滴加入到固体b中,则下列叙述不正确的是

A. 若a为浓盐酸,b为KMnO4,c中盛紫色石蕊试液,则c中溶液先变红后褪色
B. 若a为浓硫酸,b为木炭,c中盛有苯酚钠溶液,则c中出现白色浑浊
C. 若a为浓氨水,b为生石灰,c中盛A1C13溶液,则c中产生白色沉淀且沉淀不溶解
D. 若a为稀盐酸,b为大理石,c中盛有BaCl2溶液,则c中溶液不变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定体积的CH4在密闭容器中与一定量的氧气燃烧后得到的产物为CO、CO2和水蒸气,此混合气重4.96g,当其缓慢经过浓硫酸时,浓硫酸增重2.52g.原混合气体中CO2的质量为( )
A. 1.25g B. 1.32g C. 1.97g D. 2.44g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C9H10O2的有机物,其结构中含有苯环且可以与饱和NaHCO3溶液反应放出气体的同分异构体有(不考虑立体异构) ( )
A. 15种 B. 14种 C. 13种 D. 12种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质是几种常见香精的主要成分:

(1)薄荷脑的分子式为________。
(2)鉴别薄荷脑和百里香酚,可选用的试剂是________。
(3)下列对于桂醛的说法不正确的是_______________。
A.可发生加聚反应 B.可发生取代反应
C.可发生氧化反应 D.最多可与1molH2 发生加成反应
(4)写出百里香酚与足量浓溴水反应的化学方程式_________。
(5)写出往百里香酚钠溶液中通入CO2气体的化学反应方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液的化学方程式:__________________________。
(2)锌和氢氧化钠溶液反应后,溶液中锌元素的存在形式为_________(用化学式表示)。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是_______________。
① 硫酸铝和氢氧化钠 ② 硫酸锌和氢氧化钠 ③硫酸铝和氨水 ④ 硫酸锌和氨水
(4)在火箭和导弹技术中,将铝粉与石墨、TiO2按一定比例混合均匀,涂在金属表面,在高温下煅烧,金属表面生成TiC和另一种耐高温的物质,写出该反应的化学方程式:__________。
(5)某混合物![]() ,含有
,含有![]() 、
、![]() 和
和![]() ,在一定条件下可实现如图所示的物质之间的变化:
,在一定条件下可实现如图所示的物质之间的变化:
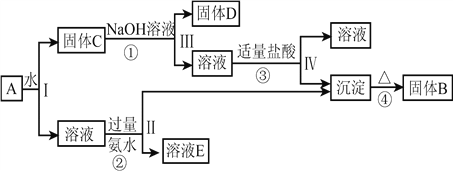
据此回答下列问题:
①写出固体![]() 的化学式:
的化学式: ![]() __________;
__________;
②写出D与稀硫酸反应的化学方程式:___________________________________________;
写出反应①的离子方程式:_________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com