
����Ŀ�����仯�����ڲ������졢�л��ϳɵȷ�����;�dz��㷺���ش��������⣺
(1)VB2��һ�ֵ����մɲ��ϣ���̬��ԭ�ӵļ۵����Ų�ͼΪ_______��
(2)B��C��N����Ԫ�ص�һ��������С�����˳��Ϊ________��
(3)���±�����ڹ�ҵ������Ҫ���ã��������±����ķе����±���ʾ��
BF3 | BCl3 | BBr3 | BI3 | |
�е�/K | 172 | 285 | 364 | 483 |
������±����е��������ߵ�ԭ����__________________��
����BF3���ӽṹ���ͷ�ӦBF3(g)+NH4F(s)==NH4[BF4] (s)�ܹ�������ԭ��____________��
�Ʊ�������ķ������£�
![]()
BCl3��LiBH4����ԭ�ӵ��ӻ������������Ϊ_________����B3N3H6��Ϊ�ȵ�����ķ��ӵĽṹ��ʽΪ________________��
(4)������������۵�Ϊ3000�棬�侧���ṹ��ͼ��ʾ����������a=361.5pm��
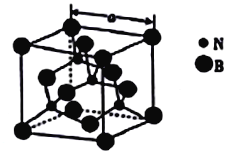
������������ľ�������Ϊ_______________��
�ڽ��ڵ�������ԭ�Ӽ�ľ���Ϊ_______(�г�����ʽ����) pm��
��������������ܶ�Ϊ_____(�г�����ʽ����)g�M-3��
���𰸡� 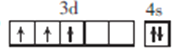 B<C<N ���ӽṹ���ƣ���Է������������Ӽ�����������ǿ BF3��������ԭ���пչ����F-�й¶Ե��ӣ���ͨ����λ���γ�BF4- sp2��sp3
B<C<N ���ӽṹ���ƣ���Է������������Ӽ�����������ǿ BF3��������ԭ���пչ����F-�й¶Ե��ӣ���ͨ����λ���γ�BF4- sp2��sp3 ![]() ԭ�Ӿ���
ԭ�Ӿ��� ![]() ��361.5
��361.5 ![]() ��107(������������)
��107(������������)
��������(1) V�ĺ˵����Ϊ23����۵����Ų�ʽΪ3d34s2�����̬��ԭ�ӵļ۵����Ų�ͼΪ![]() ��
��
(2)ͬһ����Ԫ�أ�Ԫ�صĵ�һ����������ԭ�����������������p���Ϊ������ṹ����VA���һ�����ܴ���������Ԫ�أ�B��C��NԪ�ش���ͬһ������ԭ������������N���ڵ�VA�壬��B��C��N����Ԫ�ص�һ��������С�����˳��ΪB<C<N��
(3)������±����ṹ�����Ҿ�Ϊ���Ӿ��壬��Է������������Ӽ�����������ǿ���ʷе��������ߣ�
���� BF3��������ԭ���пչ����F-�й¶Ե��ӣ���ͨ����λ���γ�BF4-����ӦBF3(g)+NH4F(s)=NH4[BF4] (s)�ܹ���������
��BCl3���ӵ�����ԭ��Bԭ���Ϻ���3���� ��������ԭ���ϵŵ��Ӷ���=![]() ����a-xb��=
����a-xb��=![]() ����3-3��1��=0������BCl3��������sp2�ӻ���LiBH4��Bԭ�ӵļ۲���Ӷ���Ϊ
����3-3��1��=0������BCl3��������sp2�ӻ���LiBH4��Bԭ�ӵļ۲���Ӷ���Ϊ![]() =4�������ӻ���ʽΪsp3�ӻ���C6H6��B3N3H6��Ϊ�ȵ����壬�����ӵĽṹ��ʽΪ
=4�������ӻ���ʽΪsp3�ӻ���C6H6��B3N3H6��Ϊ�ȵ����壬�����ӵĽṹ��ʽΪ![]() ��
��
(4)������������Ϊ���۵㣬ֻ���ڹ��ۼ���ӦΪԭ�Ӿ��壻
������ڵ�������ԭ�Ӽ�ľ���Ϊxpm����![]() xpm=361.5pm��x=
xpm=361.5pm��x=![]() ��361.5pm��
��361.5pm��
��һ�������������к���4��Nԭ�Ӻ�4��Bԭ�ӣ�һ�������е�����Ϊ![]() ��һ������������������ǣ�361.5pm��3�����������������ܶ���
��һ������������������ǣ�361.5pm��3�����������������ܶ���![]() gpm-3=
gpm-3=![]() ��107��
��107��


 ״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�
״Ԫ��ȫ��ͻ�Ƶ�����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���̷���FeSO4��7H2O��������ԭ������ɫ������ҩ�ȣ��ڲ�ͬ�¶����ֽ�ø������������������������֪SO3��һ����ɫ���壬�۵�16.8�����е�44.8���������Լ���ˮ�Խ�Ũ����ǿ����Ư��ijЩ�л�Ⱦ�ϣ���Ʒ��ȡ��ش��������⣺

��1������ͬѧ������ͼ��ʾ��װ�ã�ͨ��ʵ������̷��ķֽ������װ��B�пɹ۲쵽�������� �������ɴ˵ó��̷��ķֽ�����к���SO2��װ��C�������� ��
��2������ͬѧ��Ϊ����ͬѧ��ʵ����۲��Ͻ�����Ϊ��Ҫ����ʵ�顣�ҶԼ���ͬѧ����ʵ���Bװ�õ��Թܼ��ȣ�������ɫ��Ʒ����Һδ�ָ���ɫ�����֤���̷��ֽ�IJ����� ��������ĸ��
A������SO2 B�����ܺ�SO2 C��һ������SO3
��3������ͬѧ�������Ϸ����̷����ȷֽ������O2�ų���Ϊ�ˣ�����ͬѧѡ�ü���ͬѧ�IJ���װ�ú���ͼ����װ����Ƴ���һ�����̷��ֽ���̬�����װ�ã�

������ͬѧ��ʵ��װ���У��������ӵĺ���˳��Ϊ ��
����֤���̷��ֽ��������O2��ʵ������������� ��
��4��Ϊ֤���̷��ֽ�����к�����������ѡ�õ�ʵ���������Թܡ���ͷ�ιܡ� ��ѡ�õ��Լ�Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������������ʵ�����Ϊa mol����ÿ���������������ʵ���֮�Ȼ����ȫȼ��ʱ������O2�����������
A. ���顢�״� B. ��ϩ��������
C. ��Ȳ���� D. �Ҵ�����ϩ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֽ����ͷǽ������Ϸ��ֺ�ʹ�õ�ʱ����ᡣ��ش�
��1���ҹ�����ʹ�õĺϽ���_________��
��2��Cu��Fe��Na��Al���ֽ���Ԫ���У���������ǿ����_______����Ԫ�ط��ţ���
Al��ԭ�ӽṹʾ��ͼ��________________________��
��3���ҹ�����ʱ�ھͿ�ʼұ��ͭ�������С����������Ϊͭ���ļ��أ����ִ���ʪ����ͭ������������д��������Ӧ�Ļ�ѧ����ʽ��____________________________��
��4��19���ͳ����ƺ����ķ��ֵ����ڵ�⼼����Ӧ�á�
ұ������ԭ��Al2O3����_____�����ѡ����ԡ��������ԡ������ԡ�����ұ�����ķ�ӦΪ��2 Al2O3�����ڣ�![]() 4Al +3O2�� ����Ӧ������1molAlת�Ƶ���_________mol��
4Al +3O2�� ����Ӧ������1molAlת�Ƶ���_________mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F��G������״�л�����ǵ�ת����ϵ��ͼ��ʾ��D����Է���������E���42����ش��������⣻
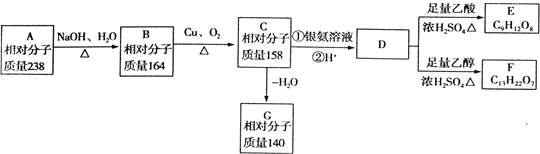
��1��D�к��еĹ�������_________�����ֹ����ŵĸ�������________��
��2��D�ĺ˴Ź�������ͼ����3���壬�ҷ����֮��Ϊ1��3��6����д��D�Ľṹ��ʽ__________��
��3��д��B����C�Ļ�ѧ����ʽ______________________________________.
��4��Aֻ��һ�ֹ����ţ���A�Ľṹ��ʽΪ___________��
��5�������廯����H��G��Ϊͬ���칹�壬1molH���������Ʒ�Ӧ����1.5molH2��������������������Һ��Ӧ����2molNaOH����H�����ϵ�һ�ȴ���ֻ�����֣�д������������H�Ľṹ��ʽ��_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Һ���ܴ����������
A. H+��NO3-��CO32- B. K+��Na+��SO42-
C. NH4+��OH-��SO42- D. Ag+��NO3-��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25��ʱ����ϡ��ˮ��μ��뵽ϡ�����У�����Һ��pH=7ʱ�����й�ϵ��ȷ����
A. c��NH4+��=c��SO42����
B. c��NH4+����c��SO42����
C. c��NH4+����c��SO42����
D. c��OH����+c��SO42����=c��H+��+c��NH4+��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���A��C��H��O����Ԫ����ɣ���Է�������Ϊ90����9.0 g A��ȫȼ�յIJ�������ͨ��������Ũ����ͼ�ʯ�ң��ֱ�����5.4 g��13.2 g��A����NaHCO3��Һ������Ӧ����2����A֮����ˮ��������Ԫ��������й�A��˵����ȷ���� ( )
A. ����ʽ��C3H8O3 B. A�������IJ����ܷ���������Ӧ
C. 0.1 mol A������Na��Ӧ����2.24 L H2(��״��) D. A��һ�������·������۷�Ӧ�IJ�����![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ҹ���ʹ������ĺϽ���_________��Ŀǰ���������;���ĺϽ���_________�������仯ѧ�ɷ֣��ɷ�Ϊ_________��_________�����ࡣ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com