
向某密闭容器中加入0.6 mol A、0.2 mol C和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如甲图所示[其中t0-t1阶段c(B)未画出]。t2时刻后改变条件反应体系中反应速率随时间变化的情况如乙图所示,且四个阶段都各改变一种条件并且改变的条件均不相同。下列说法正确的是( )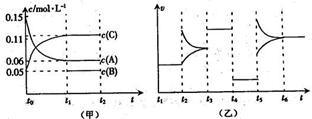
 A.反应的方程式为3A(g)+B(g) 2C(g)
A.反应的方程式为3A(g)+B(g) 2C(g)
B.t3~t4,t4~t5,t5~t6各阶段可能改变的条件依次为:加催化剂,降低反应温度,增大压强
C.B的起始物质的量为0.08 mol
D.若t1="10" s,A在t0~t1时间段的反应速率为0.00225 mol·L-1·s-1
C
解析试题分析:A、根据图甲可知反应中A的浓度变化为0.15mol/L-0.06mol/L=0.09mol/L,C的浓度变化为0.11mol/L-0.05mol/L=0.06mol/L,反应中A与C的计量数之比为0.09:0.06=3:2,t3~t4阶段与t4~t5阶段正逆反应速率都相等,而t3~t4阶段为使用催化剂,则t4~t5阶段应为减小压强,则该反应中气体的化学计量数之和前后相等,则有:3A(g) B(g)+2C(g),错误;B、t4~t5阶段应为减小压强,错误;C、A的起始物质的量为0.6 mol ,起始浓度为0.15mol?L?1,可知容器体积V=4L,根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为4L,生成B的物质的量为0.12mol,平衡时B的物质的量为0.2mol,所以起始时B的物质的量为0.2mol-0.12mol=0.08mol,正确;D、A在t0~t1时间段的反应速率为:0.09mol/L÷10s="0.009" mol·L-1·s-1,错误。
B(g)+2C(g),错误;B、t4~t5阶段应为减小压强,错误;C、A的起始物质的量为0.6 mol ,起始浓度为0.15mol?L?1,可知容器体积V=4L,根据方程式可知消耗0.09mol/L的A,则生成0.03mol/L的B,容器的体积为4L,生成B的物质的量为0.12mol,平衡时B的物质的量为0.2mol,所以起始时B的物质的量为0.2mol-0.12mol=0.08mol,正确;D、A在t0~t1时间段的反应速率为:0.09mol/L÷10s="0.009" mol·L-1·s-1,错误。
考点:本题考查图像的分析、化学方程式和条件的推断、反应速率和方程式的计算。


科目:高中化学 来源: 题型:单选题
下列叙述中,不能用平衡移动原理解释的是
| A.红棕色的NO2,加压后颜色先变深后变浅 |
| B.黄绿色的氯水光照后颜色变浅 |
| C.由H2、Br2(g)、HBr(g)气体组成的平衡体系加压后颜色变深 |
| D.工业合成氨反应中加压有利于提高氨气的产率 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
在一定温度下,向容积固定不变的密闭容器中充入amolNO2,发生如下反应:
2NO2(g) N2O4(g);△H<0。达平衡后再向容器中充入amolNO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
N2O4(g);△H<0。达平衡后再向容器中充入amolNO2,再次达到平衡后,与原平衡比较,下列叙述不正确的是( )
| A.平均相对分子质量增大 | B.NO2的转化率提高 |
| C.NO2的质量分数增大 | D.反应放出的总热量大于原来的2倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
对于平衡体系mA(g)+nB(g) pC(g)+qD(g) △H<0。下列结论中错误的是( )
pC(g)+qD(g) △H<0。下列结论中错误的是( )
A.若温度不变,将容器的体积缩小到原来的一半,达到新平衡时A的浓度为原来的2.2倍,则m+n<p+q
B.若平衡时,A、B的转化率相等,说明反应开始时,A、B的物质的量之比为m︰n
C.若m+n=p+q,则向含有a mol气体的平衡体系中再加入a mol的B,达到新平衡时,气体的总物质的量等于2a mol
D.保持其它条件不变,升高温度,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知2SO2 (g) + O2 (g)  2SO3 (g);ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2;(丙) 2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
2SO3 (g);ΔH=-197 kJ·mol-1。向同温、同体积的三个密闭容器中分别充入气体:(甲) 2 mol SO2和1 mol O2;(乙) 1 mol SO2和0.5 mol O2;(丙) 2 mol SO3。恒温、恒容下反应达平衡时,下列关系一定正确的是
| A.容器内压强P:P甲=P丙 > 2P乙 |
| B.SO3的质量m:m甲=m丙 > 2m乙 |
| C.c(SO2)与c(O2)之比k:k甲=k丙 > k乙 |
| D.反应放出或吸收热量的数值Q:Q甲=Q丙 > 2Q乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
T℃时,将6 mol CO2和8 mol H2充入2L密闭容器中,发生反应CO2 ( g ) + 3 H2 ( g )  CH3 OH ( g )+H2O( g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。则下列说法正确的是
CH3 OH ( g )+H2O( g),容器中H2的物质的量随时间变化如图中实线所示。图中虚线表示仅改变某一反应条件时,H2的物质的量随时间的变化。则下列说法正确的是
| A.反应开始至a点时υ(H2) ="1" mol·L-1·min-1 |
| B.曲线II对应的条件改变是降低压强 |
| C.若曲线I对应的条件改变是升温,则该反应△H >0 |
| D.T℃时,该反应的化学平衡常数为0.125 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
一定条件下,在体积为10L的密闭容器中,1molX和1molY进行反应:2X(g)+Y(g) Z(g),60s达到平衡,生成0.3molZ,下列说法正确的是( )
Z(g),60s达到平衡,生成0.3molZ,下列说法正确的是( )
| A.以X浓度变化表示的反应速率为0.001mol/(L·s) |
B.将容器体积变为20L,Z的平衡浓度变为原来的 |
| C.若增大压强,则物质Y的转化率减小 |
| D.若升高温度,X的体积分数增大,则该反应的△H>0 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
I2在KI溶液中存在平衡: 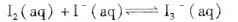 ,某I2、、KI混合溶液中, c(
,某I2、、KI混合溶液中, c(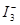 )与温度T的平衡曲线图如下。下列说法不正确的是
)与温度T的平衡曲线图如下。下列说法不正确的是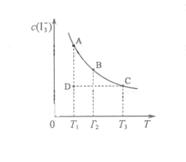
A.反应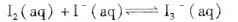 的△H>0 的△H>0 |
B.若温度为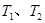 ,反应的平衡常数分别为 ,反应的平衡常数分别为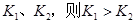 |
C.若反应进行到状态D时,一定有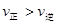 |
| D.状态A与状态B相比,状态A的c(I2) 小 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
氯气在298K、100kPa时,在1L水中可溶解0.09mol,实验测得溶于水的Cl2约有三分之一与水反应。估算该反应的平衡常数( )
| A.4.5×10-4 | B.0.015 | C.5.4×10-5 | D.无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com