
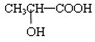 与铁粉作用生成的,请写出上述步骤②反应Ⅰ的化学方程式:
与铁粉作用生成的,请写出上述步骤②反应Ⅰ的化学方程式:| n |
| v |


科目:高中化学 来源: 题型:
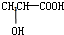 )与铁粉作用生成的,请写出该反应的化学方程式:
)与铁粉作用生成的,请写出该反应的化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下列说法正确的是____________(选填序号)。
A.在进行物质检验时,一般先对试样进行外观观察,确定其状态、颜色、气味等
B.配制银氨溶液时,应把硝酸银溶液逐滴加入氨水中
C.一般在实验室点燃可燃性气体时,必须先检验纯度
D.测定硫酸铜晶体结晶水的质量分数时,若用潮湿的坩埚会使测定结果偏小
E.酸碱中和滴定实验中根据碱式滴定管的两次读数得出NaOH溶液体积为22.0 mL
F.实验室制取氯气等有毒气体时,必须在密闭体系或通风橱中进行
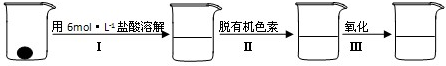
(2)补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤:
①配制0.01 mol·L-1到0.008 mol·L-1等一系列浓度的[Fe(SCN)6]3-(红色)溶液作为标准比色液。
②样品处理:

③准确量取一定体积的待测液于比色管中,加入稍过量的KSCN溶液,并稀释到10 mL。
④比色:选取与待测液颜色一致或相近的标准比色液即可判断待测液的浓度。
试回答下列问题:
①配制100 mL 0.01 mol·L-1标准溶液,需要的玻璃仪器有:烧杯、玻璃棒、量筒,还需要:_______________、_______________。
②步骤②脱色过程包括加入____________(填:脱有机色素的吸附剂名称)→搅拌煮沸→冷却→____________(填操作)。
③步骤②样品处理中,氧化的目的是______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)下列说法正确的是__________。(选填序号)
A.在进行物质检验时,一般先对试样进行外观观察,确定其状态、颜色、气味等
B.一般在实验室点燃可燃性气体时,必须先要检验纯度
C.实验室制取氯气等有毒气体时,必须在密闭体系或通风橱中进行
D.测定中和热时,环形玻璃搅拌棒要用力搅拌,使测得的温度更准确
E.测定硫酸铜晶体结晶水质量分数时,若用潮湿的坩埚会使测定结果偏大
F.石油蒸馏实验中,温度计必须插入液体中部。
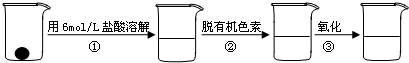
(2)补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤:
①配制 0.01 mol·L-1、0.008 mol·L-1等一系列浓度的[Fe(SCN)6]3-(红色)标准比色液
②样品处理
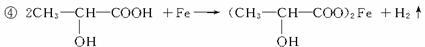
③准确量取一定体积的待测液于试管中(比色管),加入稍过量的KSCN溶液,并稀释至10 mL
④比色,直到与选取的标准颜色一致或相近即可。
试回答下列问题:
①配制100 mL 0.01 mol·L-1 [Fe(SCN)6]3-溶液,需要的玻璃仪器有:烧杯、玻璃棒、量筒,还需要___________、___________。
②步骤②脱色过程中包括加入:(填:脱有机色素的吸附剂名称)→搅拌煮沸→冷却→(填操作)。
③比色法确定待测液的浓度其原理是:_____________________________________________。
④若某补铁剂是由乳酸(![]() )与铁粉作用生成的,请写出该反应的化学方程式:____________________________________________。
)与铁粉作用生成的,请写出该反应的化学方程式:____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
在探究某补铁剂中铁元素的价态实验中,老师取一片该补铁剂用盐酸溶解,经脱色过滤后,得到250 mL近乎无色的溶液,继续加入1滴液溴,振荡,溶液变为黄色。
(1)甲同学认为这不是发生化学反应所致,因Br2水本就呈棕黄色,使溶液变黄色的物质是Br2;乙同学认为这是发生化学反应所致,使溶液变黄色的物质是_________(填粒子的化学式),发生反应的离子方程式为__________________________________________。
(2)现提供以下试剂:A.酸性高锰酸钾溶液 B.氢氧化钠溶液 C.四氧化碳 D.硫氰化钾溶液。请你用两种方法支持乙同学,写出选用的试剂编号及实验中应观察到的现象:
| 选用试剂 | 实验现象 | |
| 第一种方法 | ||
| 第二种方法 |
(3)用(2)中所提供的试剂即可验证该补铁剂经脱色后的溶液中含Fe2+而不含Fe3+。请写出实验步骤和现象。
| 实验步骤 | 实验现象 |
(4)补铁剂中铁元素含量的测定通常使用到双氧水,请写出将双氧水滴入该补铁剂经脱色后的溶液中发生反应的离子方程式______________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com