
 H++CN-,>;(2)[Au(CN)2]+
H++CN-,>;(2)[Au(CN)2]+ [Au(CN)] 2++CN-;
[Au(CN)] 2++CN-; H++CN-;(2) [Au(CN)2]+存在着两步电离,其一级电离方程式为[Au(CN)2]+
H++CN-;(2) [Au(CN)2]+存在着两步电离,其一级电离方程式为[Au(CN)2]+ [Au(CN)] 2++CN-;(3)处理含有络离子[Au(CN)2]+废水是在碱性条件下,NaClO将CN—氧化为碳酸根和氮气,根据离子方程式的书写原则,该反应的离子方程式为:5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O;(4)在酸性条件下,ClO—也能氧化CN--,但实际处理废水时却不在酸性条件下进行是因为在酸性条件下CN-与H+结合生成毒性很强的HCN,对人体造成更大的危害。
[Au(CN)] 2++CN-;(3)处理含有络离子[Au(CN)2]+废水是在碱性条件下,NaClO将CN—氧化为碳酸根和氮气,根据离子方程式的书写原则,该反应的离子方程式为:5ClO-+2CN-+2OH-=2CO32-+N2↑+5Cl-+H2O;(4)在酸性条件下,ClO—也能氧化CN--,但实际处理废水时却不在酸性条件下进行是因为在酸性条件下CN-与H+结合生成毒性很强的HCN,对人体造成更大的危害。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源:不详 题型:单选题
| A.K+、Na+、CO32-、Cl- | B.K+、Na+、NO3-、HCO3- |
| C.Na+、K+、Cl-、SO42- | D.MnO4-、Na+、Cl-、SO42- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.K+、NO3-、OH-、Cl- |
| B.SO42-、Mg2+、Cl-、Na+ |
| C.SO42-、Na+、Mg2+、CH3COO- |
| D.Cl-、SCN-、K+、Fe3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na+、CO32-、Ca2+、NO3- | B.Na+、NO3-、Al3+、Cl- |
| C.K+、SO42-、Cl-、Cu2+ | D.Ba2+、Cl-、K+、SO42- |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
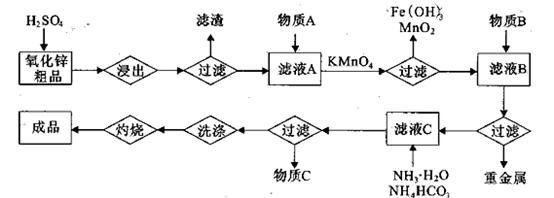
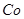 +、Mn2+等
+、Mn2+等| A.NH3.H2O | B.Na2CO3 | C.H2SO4 | D.ZnO |
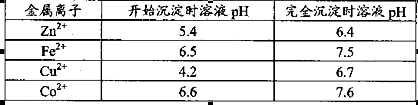
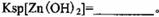 。
。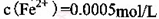 ,则处理1
,则处理1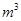 该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。
该溶液,Fe2+所消耗的KMnO4的质量为________g(保留两位有效数字)。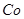 2+可利用置换反应除去,则物质B是_________。
2+可利用置换反应除去,则物质B是_________。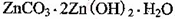 ,生成该沉淀的化学方程式为________。
,生成该沉淀的化学方程式为________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | 离子组 | 加入试剂 | 加入试剂后发生反应的离子方程式 |
| A | Fe2+、NO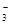 、K+ 、K+ | 稀硫酸 | 3Fe2++NO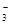 +4H+=3Fe3++NO↑+2H2O +4H+=3Fe3++NO↑+2H2O |
| B | Fe3+、I-、ClO- | 氢氧化钠溶液 | Fe3++3OH-=Fe(OH)3↓ |
| C | Ba2+、HCO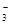 、Cl- 、Cl- | 氢氧化钠溶液 | HCO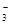 + OH-=CO + OH-=CO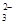 +H2O +H2O |
| D | Al3+、Cl-、NO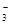 | 过量氢氧化钠溶液 | Al3++3 OH-=Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
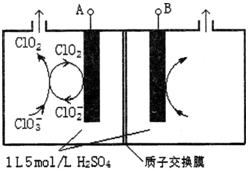
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.试剂③是AgNO3溶液,试剂⑤是HNO3,现象1中白色沉淀是AgCl |
| B.现象3中白色沉淀是BaSO4 |
| C.产生现象2的离子方程式是Br2+2H2O+SO2=4H++2Br-+SO42— |
| D.试剂②是盐酸,试剂③是硝酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe3+、Al3+、Cl-、NO3- | B.K+、Na+、I-、SO42- |
| C.Ag+、Ca2+、NH4+、NO3- | D.Na+、Ba2+、CO32-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com