
I.根据下式所表示的氧化还原反应设计一个原电池:
Cu(s) + 2Ag+(aq) = Cu2+(aq) + 2Ag(s)
(1)装置可采用烧杯和盐桥(不需标明盐桥种类),画出此原电池的装置图(标明所用电解质溶液化学式);
(2)注明原电池的正极和负极;
(3)注明外电路中电子的流向;
(4)写出正极上的电极反应式:
(+) ;
(5)指出盐桥中阳离子移动方向: 。
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
氨气是中学化学中常见的气体,其用途广泛。
(1)实验室制取氨气的化学方程式是 。
 (2)工业上氨气可以由氢气和氮气合成。
(2)工业上氨气可以由氢气和氮气合成。
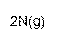


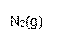
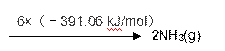
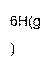
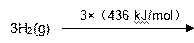

① 该反应的热化学方程式是 。
② 随着温度的升高,该反应的化学平衡常数的变化趋势是 。
③ 一定温度下,2 L密闭容器中,5 molN2和5 molH2发生反应,达到平衡时,N2的转化率为20%,该温度下反应的平衡常数的数值是 。
④ 简述一种检查氨气是否泄露可采用的化学方法: 。
(3)工业制硫酸的尾气中含较多的SO2,为防止污染空气,回收利用SO2,工业上常用氨水吸收法处理尾气。
① 写出氨水吸收SO2 的化学反应方程式 。
② (NH4)2SO3显碱性,用化学用语和必要的文字解释其原因 。
查看答案和解析>>
科目:高中化学 来源: 题型:
以铜为电极,a mol/L的硫酸铜溶液作电解液,对含有铁、锌、银的粗铜进行电解精炼,下列有关说法中正确的是( )
①粗铜应与电源的负极相连
②当有1 mol精铜析出时,就有2NA个电子通过电解质溶液
③阴极上的反应只有:Cu2++2e-===Cu
④电解结束时,c(CuSO4)<a mol/L
⑤杂质银以Ag2SO4形式沉入电解池形成“阳极泥”
A.②③ B.③④
C.①②④⑤ D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,用甲烷可以消除氮氧化物(NOx)的污染。已知:
① CH4 (g)+4NO2 (g)=4NO (g) +CO2 (g)+2H2O (g) △H=-574 kJ·mol-1
② CH4 (g)+4NO (g)=2N2 (g)+CO2 (g)+2H2O (g) △H=-1160 kJ·mol-1。
下列选项正确的是( )
A.CH4 (g)+2NO2 (g)= N2 (g)+CO2 (g)+2H2O (l) △H=-867 kJ·mol-1
B.若0.2 mol CH4还原NO2至N2,在上述条件下放出的热量为173.4 kJ
C.1molCH4催化还原NOx为N2的过程中,若x=1.6,则转移的电子为3.2 mol
D.若用4.48L CH4还原NO2至N2,整个过程中转移的电子为3.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl = Na2Mn5O10+2AgCl,下列“水” 电池在海水中放电时的有关说法正确的是( )
A. 正极反应式:Ag+Cl--e-=AgCl
B. 每生成1 mol Na2Mn5O10转移2 mol电子
C. Na+不断向“水”电池的负极移动 D. AgCl是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.汽油、柴油、植物油都属烃类物质且均为纯净物
B.单质硅常用于制造芯片和光导纤维
C.等质量的气态乙醇和液态乙醇分别完全燃烧,前者放出的热量更多
D.漂白精和明矾都常用于自来水的处理,二者作用原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
三氯化磷(PCl3)是一种重要的有机合成催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如下图所示。

已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl。PCl3、POCl3的熔沸点见下表。
| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
请回答:
(1)写出A中反应的离子方程式 。
(2)B装置中所盛试剂是 ;E中烧杯内冷水的作用是 。
(3)实验前玻璃管之间连接需要用到橡皮管,其连接方法是:先把 ,然后稍稍用力即可把玻璃管插入橡皮管中。
(4)检查装置气密性后,向D装置的曲颈瓶中加入红磷,打开K3通入干燥的CO2,一段时间后关闭K3,加热曲颈瓶至上部有黄色升华物出现时通入氯气,反应立即进行。其中通入干燥CO2的目的是 。
(5)实验制得的粗产品中常含有POCl3、PCl5等,加入红磷加热除去PCl5后,再通过 (填实验名称)即可得到较纯净的PCl3。
(6)实验后关闭K1,打开K2,将A、B中余氯通入300ml 1mol/L的NaOH溶液中。若NaOH恰好完全反应,则吸收氯气的物质的量为(假设反应生成了NaCl 、 NaClO 和 NaClO3 等钠盐) mol,反应中转移电子的物质的量(n)的范围是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关问题,与盐的水解有关的是
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂 ②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂 ③草木灰与铵态氮肥不能混合施用 ④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞 ⑤Al2S3不能通过溶液中的反应制取
A.①②③ B.②③④ C.①④⑤ D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
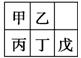
短周期金属元素甲~戊在元素周期表中的相对位置如右表所示,
下面判断正确的是
A.氢氧化物碱性:丙>丁>戊 B.金属性:甲>丙
C.原子半径: 丙<丁<戊 D.最外层电子数:甲>乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com