

| ���� | ��ʼ����ʱ��pH | ��ȫ����ʱ��pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ���� | ��ʼ����ʱ��pH | ��ȫ����ʱ��pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ���� | ��ʼ����ʱ��pH | ��ȫ����ʱ��pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
| ||
| ||
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

| ���� | ��ʼ����ʱ��pH | ��ȫ����ʱ��pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013��ӱ�ʡ�߶���ѧ����ĩ���Ի�ѧ�Ծ� ���ͣ������
��14�֣���ij����С����Ƴ����ù�ҵ���ᣨ10%H2SO4�����ѽ�ij����������ͭп����ȡ����ZnO�ķ�����ʵ�ַ����ۺ����ã���������ͼ��ʾ��

��֪��298Kʱ�����ӿ�ʼ��������ȫ����ʱ��pH���±���ʾ��
|
���� |
��ʼ����ʱ��pH |
��ȫ����ʱ��pH |
|
Fe2�� |
6��34 |
9��7 |
|
Fe3�� |
1��48 |
3��2 |
|
Zn2�� |
6��2 |
8��0 |
��ش��������⣺
��1������ͭп���к���������CuS��ZnS����H2SO4��������ZnS�����ܽ��CuS
���ܣ�����������ͬ�¶��£�Ksp��CuS�� Ksp��ZnS����ѡ�������������������
��2������Ϊ�ڳ���������ѡ�����������е� ������ţ���Ϊ�Լ����DZȽϺ��ʵġ�
A��KMnO4 B��HNO3 C��H2O2 D��Cl2
��3�����������м��백ˮ��Ŀ���ǵ�����Һ��pH��pHӦ������ ��Χ֮�䡣
��4����д���Ӽ����ʺ��백ˮ���Ƶ�����Һ��pH������Fe��OH��3��Ӧ�����ӷ���ʽ ��
��5��298Kʱ������������Һ�е�c��Fe3������ __ mol/L���¡�
[Fe��OH��3��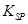 = 2��70��10-39]
= 2��70��10-39]
��6���ҵ���Һ��ֱ���������ʣ����ҵĻ�ѧʽ�� ��
��7����д��������Zn2+�������з�����Ӧ�Ļ�ѧ����ʽ ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com