
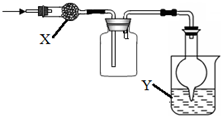
 如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( )
如图是用于干燥、收集并吸收多余气体的装置,下列方案正确的是( ) | 选项 | X | 收集气体 | Y |
| A | 碱石灰 | 氯气 | 水 |
| B | 碱石灰 | 氨气 | 水 |
| C | 氯化钙 | 二氧化硫 | 氢氧化钠 |
| D | 氯化钙 | 一氧化氮 | 氢氧化钠 |
| A. | A | B. | B | C. | C | D. | D |
分析 该装置中采用向上排空气法收集,说明该气体密度大于空气,且该气体和空气中成分不反应,用固体干燥剂干燥,则该气体和干燥剂不反应,据此结合选项进行判断.
解答 解:A.碱石灰呈碱性,能与氯气反应,所以氯气不能用碱石灰干燥,且氯气吸收多余的氯气应该用碱液,故A错误;
B.氨气密度小于空气,应该采用向下排空气法收集,故B错误;
C.二氧化硫密度大于空气且常温下和空气中成分不反应,氯化钙和二氧化硫不反应,所以能用氯化钙干燥,故C正确;
D.常温下NO和氧气反应生成红棕色气体二氧化氮,所以得不到NO,NO采用排水法收集,故D错误;
故选C.
点评 本题考查了气体的干燥、收集和尾气处理,题目难度不大,根据气体的性质确定干燥剂、尾气处理试剂,根据气体的溶解性及密度确定收集方法,注意氨气不能用氯化钙干燥,为易错点.


 53随堂测系列答案
53随堂测系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属氧化物一定是碱性氧化物,非金属氧化物不一定是酸性氧化物 | |
| B. | 有单质参加或生成的化学反应一定是氧化还原反应 | |
| C. | 金属阳离子被还原一定得到相应的金属单质 | |
| D. | 在氧化还原反应中金属单质只能作还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | SO2+2NaOH═Na2SO3+H2O | B. | SO2+H2O+(NH4)2SO3═2NH4HSO3 | ||
| C. | SO2+N02═SO3+NO | D. | SO2+H2O+Br2═H2SO4+2HBr |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1,3-丁二烯的实验式:C4H6 | B. | 乙醇的分子式:C2H5OH | ||
| C. | 甲醛的结构式: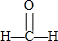 | D. | 聚丙烯的结构简式: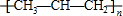 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入盐酸 | B. | 通入CO2 | ||
| C. | 加热至固体质量不再减少为止 | D. | 加入NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com