
 元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4-(绿色)、Cr2O72-(橙红色)、CrO42-(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:分析 (1)溶液Cr3+(蓝紫色)和氢氧化钠溶液反应生成Cr(OH)3为难溶于水的灰蓝色固体,和氢氧化铝性质相似为两性氢氧化物,溶于强碱;
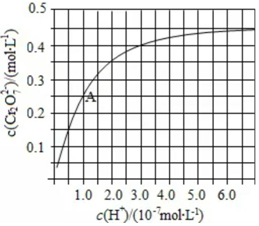
(2)①图象分析可知随氢离子浓度增大,铬酸根离子转化为重铬酸根离子;②溶液酸性增大,平衡2CrO42-+2H+?Cr2O72-+H2O正向进行,CrO42-的平衡转化率增大;A点Cr2O72-的浓度为0.25mol/L,则消耗的CrO42-的浓度为0.5mol/L,则溶液中的c(CrO42-)=1.0mol/L-0.25mol/L×2=0.5mol/L,H+浓度为1×10-7mol/L,计算反应的平衡常数;
③升高温度,溶液中CrO42-的平衡转化率减小,平衡逆向移动;
(3)当溶液中Cl-完全沉淀时,即c(Cl-)=1.0×10-5mol/L,依据Ksp(AgCl)=2.0×10-10,计算得到c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$,依据计算得到的银离子浓度和溶度积常数计算此时溶液中c(CrO42-)=$\frac{Ksp(A{g}_{2}Cr{O}_{4})}{{c}^{2}(A{g}^{+})}$;
(4)利用NaHSO3的还原性将废液中的Cr2O72-还原成Cr3+.
解答 解:(1)Cr3+与Al3+的化学性质相似可知Cr2(SO4)3溶液中逐滴加入NaOH溶液,先生成Cr(OH)3灰蓝色沉淀,继续加入NaOH后沉淀溶解,生成绿色Cr(OH)4-;
故答案为:蓝紫色溶液变浅,同时有灰蓝色沉淀生成,然后沉淀逐渐溶解形成绿色溶液;
(2)①随着H+浓度的增大,CrO42-转化为Cr2O72-的离子反应式为:2CrO42-+2H+?Cr2O72-+H2O,
故答案为:2CrO42-+2H+?Cr2O72-+H2O;
②溶液酸性增大,平衡2CrO42-+2H+?Cr2O72-+H2O正向进行,CrO42-的平衡转化率增大;A点Cr2O72-的浓度为0.25mol/L,则消耗的CrO42-的浓度为0.5mol/L,则溶液中的c(CrO42-)=1.0mol/L-0.25mol/L×2=0.5mol/L,H+浓度为1×10-7mol/L,此时该转化反应的平衡常数为 K=$\frac{[C{r}_{2}{{O}_{7}}^{2-}]}{[{H}^{+}]^{2}•[Cr{{O}_{4}}^{2-}]^{2}}$=$\frac{0.25}{0.{5}^{2}×(1{0}^{-7})^{2}}$=1.0×1014,
故答案为:增大;1.0×1014;
③升高温度,溶液中CrO42-的平衡转化率减小,平衡逆向移动,说明正方向放热,则该反应的△H<0,
故答案为:小于;
(3)当溶液中Cl-完全沉淀时,即c(Cl-)=1.0×10-5mol/L,依据Ksp(AgCl)=2.0×10-10,计算得到c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=$\frac{2.0×1{0}^{-10}}{1.0×1{0}^{-5}}$=2.0×10-5mol/L
此时溶液中c(CrO42-)=$\frac{Ksp(A{g}_{2}Cr{O}_{4})}{{c}^{2}(A{g}^{+})}$=$\frac{2.0×1{0}^{-12}}{(2.0×1{0}^{-5})^{2}}$=5.0×10-3mol/L,
故答案为:2.0×10-5 ;5.0×10-3;
(4)利用NaHSO3的还原性将废液中的Cr2O72-还原成Cr3+,发生反应的离子方程式为:5H++Cr2O72-+3HSO3-=2Cr3++3SO42-+4H2O,
故答案为:5H++Cr2O72-+3HSO3-=2Cr3++3SO42-+4H2O.
点评 本题考查化学反应原理的分析与探究、化学平衡常数、溶度积常数的计算的知识,注意平衡常数的理解应用,题目难度中等.


科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 打开汽水瓶盖,冒出大量气泡 | |
| B. | 实验室常用排饱和食盐水法收集Cl2 | |
| C. | 平衡体系2NO2?N2O4△H<0,升高温度,颜色变深 | |
| D. | 平衡体系H2(g)+I2(g)?2HI(g),缩小体积,颜色变深 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①的产物比②的产物稳定 | |
| B. | I2(s)=I2(g)△H=+17.00KJ•mol-1 | |
| C. | ②的反应物总能量比①的反应物总能量低 | |
| D. | 1molI2(g)中通入1molH2(g),发生反应时放热9.48KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10g H2和10g O2 | B. | 5.6LN2(标准状况)和11gCO2 | ||
| C. | 9g H2O和1mol Br2 | D. | 224ml H2(标准状况)和0.1mol N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2和O2反应生成水 | B. | CuO投入稀硫酸中 | ||
| C. | 高温煅烧石灰石制CO2 | D. | NaOH溶液和K2SO4溶液混合 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度可以增大活化分子百分数,从而使反应速率增大 | |
| B. | Li、Be、B三种元素的第一电离能(I1)差别不大,而I2差别很大,则三种原子中最难失去第二个电子的是Be | |
| C. | 液氯溶于水后能导电,因此液氯是电解质 | |
| D. | 固体NH5的所有原子的最外层均满足2个或8个电子的稳定结构,它与水反应的化学方程式为NH5+H2O═NH3•H2O+H2↑ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com