
分析 (1)根据溶液的酸碱性判断溶液的pH大小,酸和碱溶液抑制了水的电离,盐溶液促进了水的电离,酸或者碱溶液中氢离子、氢氧根离子浓度越大,水的电离程度越小,据此进行解答;
(2)氯化铵溶液中铵根离子水解显酸性;根据Kh=$\frac{Kw}{{K}_{1}}$计算出NaHCO3的水解平衡常数Kh;
(3)$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{c({H}^{+})}{K(铵根离子水解平衡常数)}$,通入氨气后,溶液中氢氧根离子浓度增大,氢离子浓度减小,该比值减小;
(4)先比较等体积混合后溶液的酸碱性,然后判断溶液显示中性时二者体积关系.
解答 解:(1)相同浓度的溶液中,①H2SO4溶液为酸性溶液,②NaHCO3溶液中碳酸根离子部分水解,溶液显示弱碱性,③NH4Cl溶液中铵离子部分水解,溶液显示弱酸性,④NaOH溶液为强碱溶液,所以这4种溶液pH由大到小的顺序为:④②③①;②③为含有弱酸根或者弱碱根离子的盐溶液,促进了水的电离,而①④分别为酸和碱溶液,抑制了水的电离,其中①电离的氢离子浓度大于④电离的氢氧根离子,所以①中水的电离程度最小,
故答案为:④②③①;①;
(2)氯化铵溶液中铵根离子水解显酸性,故有:c(H+)>c(OH-),结合电荷守恒可知:c(Cl-)>c(NH4+)>c(H+)>c(OH-);碳酸氢钠溶液中的水解平衡常数为:Kh=$\frac{{K}_{w}}{{K}_{1}}$=$\frac{1{0}^{-14}}{4×1{0}^{-7}}$mol/L=2.5×10-8 mol/L,
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);2.5×10-8;
(3)设铵离子的水解常数为K,K=$\frac{c(N{{H}_{4}}^{+})•c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$,则$\frac{c(N{{H}_{4}}^{+})}{c(N{H}_{3}•{H}_{2}O)}$=$\frac{c({H}^{+})}{K(铵根离子水解平衡常数)}$,该比值与溶液中氢离子浓度变化有关,当加入少量氨气后,溶液中氢氧根离子浓度增大,氢离子浓度减小,所以此比值减小,
故答案为:减小;
(4)若氯化铵与氢氧化钠溶液等浓度等体积混合,二者恰好反应生成氯化钠和氨水,溶液显示碱性,若要使溶液显示中性,则氯化铵的体积应该大些或者氢氧化钠溶液体积小些,即氯化铵溶液体积大于氢氧化钠溶液体积,
故答案为:大于.
点评 本题考查了水的电离、弱电解质的电离平衡、盐的水解原理、离子浓度大小比较等知识,题目难度中等,注意明确溶液酸碱性与溶液pH的关系及计算方法,掌握影响水的电离、盐的水解的因素,能够利用电荷守恒、物料守恒等比较溶液中离子浓度大小.


 优生乐园系列答案
优生乐园系列答案科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:Na2CO3<NaHCO3 | |
| B. | 与相同浓度盐酸反应的快慢:Na2CO3>NaHCO3 | |
| C. | 106gNa2CO3和84gNaHCO3分别与过量盐酸反应,放出CO2质量:Na2CO3>NaHCO3 | |
| D. | Na2CO3 和NaHCO3均可与澄清石灰水反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl 在同浓度的 CaCl2和 NaCl 溶液中的溶解度相同 | |
| B. | 0.1 mol?L-1 的 Na2S 溶液中,c(OH-)=c(H+)+c(HS-)+c(H2S) | |
| C. | 含有 NH4+、Cl-、H+、OH-的溶液中,其离子浓度一定是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| D. | pH=4.5 的番茄汁中 c(H+) 是 pH=6.5 的牛奶中 c(H+)的 100 倍 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Cl-、NO3-、S2- | B. | Na+、Ca2+、Cl-、HCO3- | ||
| C. | K+、Ba2+、Cl-、NO3- | D. | SO42-、Mg2+、I-、S2O32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,22.4L 氢气含有氢分子个数为NA | |
| B. | 标准状况下,11.2 L 水含有水分子个数为0.5NA | |
| C. | 1L 0.3mol•L-1Na2SO4 溶液中,含有Na+和SO42- 总数为0.6NA | |
| D. | 18g水含有电子数为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 玻璃仪器都可以用于加热,但有些可以直接加热,有些需要垫上石棉网加热 | |
| B. | 给试管中的液体加热时,试管口不准对着别人,但可以对着自己 | |
| C. | 用H2还原氧化铜的实验中,应把H2通过预先加热的氧化铜 | |
| D. | 无论给试管中的液体还是固体加热,都必须先预热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
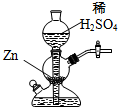
| A. | 将稀硫酸改为浓硫酸 | B. | 向稀硫酸中加入少量CuSO4固体 | ||
| C. | 向稀硫酸中加入AgNO3溶液 | D. | 给装置中发生反应的部分加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com