

| 温度/℃ | 0 | 10 | 30 | 50 | 56.7 | 60 | 70 | 80 | 90 |
| 溶解度 | 14.0 | 17.0 | 25.0 | 33.0 | 35.2 | 35.3 | 35.6 | 33.0 | 33.5 |
| 析出晶体 | FeSO4?7H2O | FeSO4?4H2O | FeSO4?H2O | ||||||
| ||
| ||


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
| A、溴乙烷中滴入AgNO3溶液检验其中的溴元素:Br-+Ag+═AgBr↓ |
| B、用醋酸除去水垢:CaCO3+2H+═Ca2++H2O+CO2↑ |
| C、利用腐蚀法制作印刷线路板:Fe3++Cu═Fe2++Cu2+ |
D、用液溴和苯在催化剂作用下制溴苯: |
查看答案和解析>>
科目:高中化学 来源: 题型:
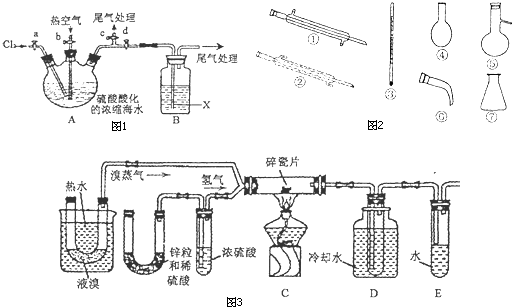
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Pb为正极,被氧化 |
| B、溶液的pH不断减小 |
| C、SO42-只向PbO2处移动 |
| D、电解液密度不断减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、离子化合物中一定含有离子键 |
| B、单质分子中均不存在化学键 |
| C、共价化合物中含有离子键 |
| D、含有共价键的化合物一定是共价化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com