
| A、原混合物中铜和铁各0.075 mol |
| B、稀硝酸的物质的量浓度为2.0 mol?L-1 |
| C、第一次剩余4.8 g 金属为铜和铁 |
| D、向反应后的溶液中再加入该稀硝酸100 mL,又得到NO在标准状况下体积小于1.12 L |
| 2 |
| 3 |
| 2.24 |
| 22.4 |
| 0.4mol |
| 0.2L |
| 0.075mol×1 |
| 3 |


科目:高中化学 来源: 题型:
| A、苯(甲苯):加酸性KMnO4溶液,振荡后分液 |
| B、甲烷(乙烯):通过盛有溴水的洗气瓶 |
| C、乙醇(丙三醇):用分液漏斗分液 |
| D、苯(苯酚):加浓溴水,后过滤 |
查看答案和解析>>
科目:高中化学 来源: 题型:
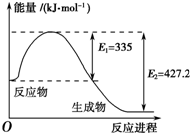 氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:
氮是地球上含量丰富的一种元素,氮及其化合物在工农业生产、生活中有着重要作用.请回答下列问题:| 化学键 | H-H | N-H | N≡N |
| 键能kJ?mol-1 | 436 | 391 | 945 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若V1>V2,c1=c2,则混合溶液的PH>7 |
| B、若混合溶液的PH=7,则c1V1<c2V2 |
| C、若c1=c2,混合溶液中c(NH4+)=c(Cl-),则V1>V2 |
| D、以上说法均不正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、150mL1mol/L氯化钠溶液 |
| B、75mL2mol/L 氯化铵溶液 |
| C、150mL1mol/L氯化钾溶液 |
| D、75mL3mol/L氯化钾溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、二者的体积相等 |
| B、在同温同压下密度相等 |
| C、在标准情况下质量相等 |
| D、二者的分子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、11 | B、14 | C、0 | D、3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7a:10d |
| B、10a:7d |
| C、10b:7e |
| D、7e:11b |
查看答案和解析>>
科目:高中化学 来源: 题型:
 将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:
将1.2mol的A气体充入2L恒容密闭容器中发生反应:A(g)?2B(g).在三种不同条件下进行实验,A的物质的量随时间的变化如图所示.试回答下列问题:| 实验编号及其目的 | V(容积)/L | t/℃ | n(A起始)/mol | n(B起始)/mol | 催化剂的质量/g | 催化剂的表面积/m2?g-1 |
| 实验1 参照对比实验 | 2 | 80 | 1.2 | 0 | a | b |
| 实验4:催化剂的表面积对反应速率的影响 | ||||||
| 实验5目的: | 1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com