
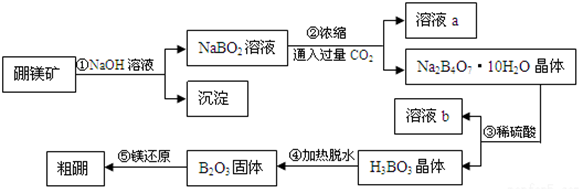
分析 硼镁矿与氢氧化钠溶液反应,过滤除去杂质,NaBO2溶液中,通入过量的二氧化碳,得到Na2B4O7•10H2O与为NaHCO3,过滤分离,由于硼酸的酸性小于硫酸,符合复分解反应由强酸制弱酸的原理,且硼酸的溶解度较小,故Na2B4O7•10H2O晶体与硫酸反应得到硼酸,溶液b中含有硫酸钠,硼酸晶体加热分解得到B2O3,最后用Mg还原得到粗硼.
(1)根据化合价代数和为0计算B元素化合价;
(2)由上述分析可知,第①步通入过量二氧化碳,则a为NaHCO3,第③步加入硫酸,b为Na2SO4;
(3)第①步为Mg2B2O5.H2O与氢氧化钠溶液反应生成NaBO2与Mg(OH)2;
(4)步骤⑤是Mg与B2O3发生置换反应生成B与MgO;
(5)符合复分解反应由强酸制弱酸的原理;
(6)BF3分子中B原子与F原子之间形成1对共用电子对;
(7)乙硼烷在空气中燃烧生成B2O3与水.
解答 解:硼镁矿与氢氧化钠溶液反应,过滤除去杂质,NaBO2溶液中,通入过量的二氧化碳,得到Na2B4O7•10H2O与为NaHCO3,过滤分离,由于硼酸的酸性小于硫酸,符合复分解反应由强酸制弱酸的原理,且硼酸的溶解度较小,故Na2B4O7•10H2O晶体与硫酸反应得到硼酸,溶液b中含有硫酸钠,硼酸晶体加热分解得到B2O3,最后用Mg还原得到粗硼.
(1)根据化合价代数和为0,可知Mg2B2O5•H2O中B的化合价为+3,故答案为:+3;
(2)由上述分析可知,第①步通入过量二氧化碳,则a为NaHCO3,第③步加入硫酸,b为Na2SO4,
故答案为:NaHCO3;Na2SO4;
(3)第①步为Mg2B2O5.H2O与氢氧化钠溶液反应生成NaBO2与Mg(OH)2,反应方程式为:Mg2B2O5•H2O+2NaOH=2NaBO2+2Mg(OH)2,
故答案为:Mg2B2O5•H2O+2NaOH=2NaBO2+2Mg(OH)2;
(4)步骤⑤是Mg与B2O3发生置换反应生成B与MgO,反应方程式为:B2O3+3Mg$\frac{\underline{\;\;△\;\;}}{\;}$2B+3MgO,
故答案为:B2O3+3Mg$\frac{\underline{\;\;△\;\;}}{\;}$2B+3MgO;
(5)步骤③中化学反应可以发生的原因是:硼酸的酸性小于硫酸,符合复分解反应由强酸制弱酸的原理,且硼酸的溶解度较小,从溶液中析出有利于该反应的进行,
故答案为:硼酸的酸性小于硫酸,符合复分解反应由强酸制弱酸的原理,且硼酸的溶解度较小,从溶液中析出有利于该反应的进行;
(6)BF3分子中B原子与F原子之间形成1对共用电子对,B原子形成3故B-F键,故分子中B原子最外层电子数为3+3=6,F原子最外层电子数为7+1=8,
故答案为:6;8;
(7)乙硼烷在空气中燃烧生成B2O3与水,反应方程式为:B2H6+3O2$\frac{\underline{\;点燃\;}}{\;}$B2O3+3H2O,
故答案为:B2H6+3O2$\frac{\underline{\;点燃\;}}{\;}$B2O3+3H2O.
点评 本题考查化学制备方案,理解工艺流程原理是解题关键,侧重对化学用语的考查,需要学生具备扎实的基础与灵活运用的能力,难度中等.


 小学教材完全解读系列答案
小学教材完全解读系列答案科目:高中化学 来源: 题型:多选题
| A. | 上述实验证明氧化性:MnO4->Cl2>Fe3+>I2 | |
| B. | 上述实验中,共有两个氧化还原反应 | |
| C. | 实验①生成的气体不能使湿润的淀粉KI试纸变蓝 | |
| D. | 实验②证明Fe2+有还原性,保存FeCl2溶液时,要向溶液中加入少量铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol NaHSO4晶体中离子总数为3NA | |
| B. | 2.24L14CH4分子中所含中子数为0.8NA | |
| C. | 0.1L 3 mol•L-1的NH4NO3溶液中含有的NH4+数目为0.3 NA | |
| D. | 标况下,将FeSO4溶液置于空气中,被氧化的Fe2+为0.2 NA,吸收O2为1.12 L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 8g | B. | 15.5g | C. | 11.7g | D. | 无法确定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某无色溶液,可能含有以下离子中的若干种:H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现各取两份100mL溶液进行如下实验:
某无色溶液,可能含有以下离子中的若干种:H+、NH4+、K+、Mg2+、Cu2+、Al3+、NO3-、CO32-、SO42-,现各取两份100mL溶液进行如下实验:| 一定含有的阳离子种类 | ||||||
| 物质的量浓度(mol/L) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 茶叶中含咖啡碱,能溶于水、乙醇,更易溶于氯仿(CHCl3),178℃时快速升华.另外茶叶中还含有11%~12%的丹宁酸,也易升华,易溶于水及乙醇,但不溶于氯仿.现从茶叶中提取咖啡碱流程如下:
茶叶中含咖啡碱,能溶于水、乙醇,更易溶于氯仿(CHCl3),178℃时快速升华.另外茶叶中还含有11%~12%的丹宁酸,也易升华,易溶于水及乙醇,但不溶于氯仿.现从茶叶中提取咖啡碱流程如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 沉淀物 | 开始沉淀时的pH | 完全沉淀时的pH |
| Al(OH)3 | 3.8 | 5.2 |
| Fe(OH)3 | 2.7 | 3.2 |
| Fe(OH)2 | 7.6 | 9.7 |
| Ai(OH)2 | 7.1 | 9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C的物质的量浓度 | B. | 混合气体的密度 | ||
| C. | 容器内压强 | D. | 混合气体的平均分子量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
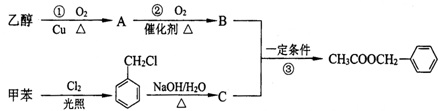
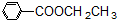 、
、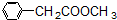 、
、
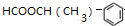 和
和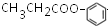 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com