
| A. | 10mL质量分数为98%的H2SO4,用10mL水稀释后,H2SO4的质量分数大于49% | |
| B. | 配制0.1mol/L的Na2CO3溶液480mL,需用500mL容量瓶 | |
| C. | 在标况下,将22.4L氨气溶于1L水中,得到1mol/L的氨水 | |
| D. | 同温同压下,20mLCH4和60mLO2所含的原子数之比为5:6 |
分析 A.等体积稀释时,水的质量小于硫酸的质量;
B.容量瓶具有固定的规格,选择时与配制溶液的体积要接近;
C.结合n=$\frac{V}{Vm}$、c=$\frac{n}{V}$计算;
D.同温同压下,体积比等于物质的量比,结合分子构成计算.
解答 解:A.等体积稀释时,水的质量小于硫酸的质量,则H2SO4的质量分数大于49%,故A正确;
B.容量瓶具有固定的规格,选择时与配制溶液的体积要接近,则配制0.1mol/L的Na2CO3溶液480mL,需用500mL容量瓶,故B正确;
C.在标况下,将22.4L氨气溶于1L水中,由n=$\frac{V}{Vm}$可知气体的物质的量,但溶液体积未知,不能由c=$\frac{n}{V}$计算浓度,故C错误;
D.同温同压下,体积比等于物质的量比,则20mLCH4和60mLO2所含的原子数之比为20×5:60×2=5:6,故D正确;
故选C.
点评 本题考查物质的量的计算,为高频考点,把握质量、物质的量、体积的关系为解答的关键,侧重分析与计算能力的考查,注意基本计算公式的应用,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 将pH=2的酸溶液稀释到原来的$\frac{1}{10}$,溶液的pH一定变为3 | |
| B. | 将pH=2的盐酸和pH=4的盐酸等体积混合后,溶液的pH变为3 | |
| C. | 将pH=12的Ba(OH)2溶液稀释到原来的$\frac{1}{10}$,溶液的pH变为13 | |
| D. | 将0.005mol•L-1的硫酸与pH=12的Ba(OH)2溶液等体积混合后,溶液的pH为7 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
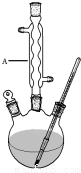 冬青油又叫水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(
冬青油又叫水杨酸甲酯,是一种重要的有机合成原料.某化学小组用水杨酸(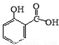 )和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.
)和甲醇在酸性催化剂催化下合成水杨酸甲酯并计算其产率.| 名称 | 分子量 | 颜色状态 | 相对密度 | 熔点(℃) | 沸点(℃) |
| 水杨酸甲酯 | 152 | 无色液体 | 1.18 | -8.6 | 224 |
| 水杨酸 | 138 | 白色晶体 | 1.44 | 158 | 210 |
| 甲醇 | 32 | 无色液体 | 0.792 | -97 | 64.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用CO2合成聚碳酸酯等可降解塑料,减少白色污染 | |
| B. | 研究采煤、采油新技术,尽量提高其产量以满足工业生产快速发展的需求 | |
| C. | 大力推广农作物的生物防治技术,以减少农药的使用 | |
| D. | 研发光电转换材料,充分利用太阳能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 工业上合成氨采用铁触媒作催化剂加快反应速率 | |
| B. | 啤酒瓶打开瓶盖产生大量气泡 | |
| C. | 加热蒸发MgCl2溶液得到Mg(OH)2 | |
| D. | 实验室用排饱和食盐水法收集氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 中性溶液中pD=8-lg4 | |
| B. | 含有0.01 mol NaOD的D2O溶液1 L,pD=12.0 | |
| C. | 溶解0.01 mol DCl的D2O溶液1 L,pD=12.0 | |
| D. | 在100 mL 0.25 mol/L的DCl重水溶液中,加入50 mL 0.20 mol/L NaOD重水溶液,pD=1.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液中滴入氢氧化钠溶液:CO32-+H++OH-=CO32-+H2O | |
| B. | 浓烧碱溶液中加入铝片:Al+2OH-=AlO2-+H2O | |
| C. | 用NaOH溶液溶解Al2O3:2OH-+Al2O3=2AlO2-+H2O | |
| D. | 向氢氧化钠溶液中通入过量的二氧化碳:CO2+2OH-=CO32-+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com