
(4分)工业上用MnO2为原料制取KMnO4,主要生产过程分为两步进行:第一步将MnO2和KOH、粉碎,混匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4的浓溶液用惰性电极进行电解,在阳极上得到KMnO4,在阴极上得到KOH。电解K2MnO4的浓溶液时,两极发生的电极反应式:
阴极是 ,阳极是 ;
电解的总反应方程式是 。
 灵星计算小达人系列答案
灵星计算小达人系列答案科目:高中化学 来源: 题型:
【化学选修2:化学与技术】(15分)
工业上为了使原料和能量得到充分的利用,常常采用循环操作。
I、利用热化学循环制氢能缓解能源矛盾。最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢。MnFe2O4的制备:
已知Fe3+、Mn2+沉淀的pH如右表所示。
|
| 开始沉淀 | 完全沉淀 |
| Fe3+ | 2.7 | 4.2 |
| Mn2+ | 8.3 | 10.4 |
(1)此工艺中理论上投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比应为 。
(2)控制pH的操作中m的值为 。
II、用MnFe2O4热化学循环制取氢气:
(3)由上可知,H2燃烧的热化学方程式是 。
(4)该热化学循环制取氢气的优点是 (填字母编号)。
A.过程简单、无污染 B.物料可循环使用
C.氧气和氢气在不同步骤生成,安全且易分离
III、工业上可用H2、HCl通过下图的循环流程制取太阳能材料高纯硅。
反应①
反应②:
(5)上图中,假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率和反应②中H2的利用率均为75%。则在下一轮次的生产中,需补充投入HCl和H2的体积比是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
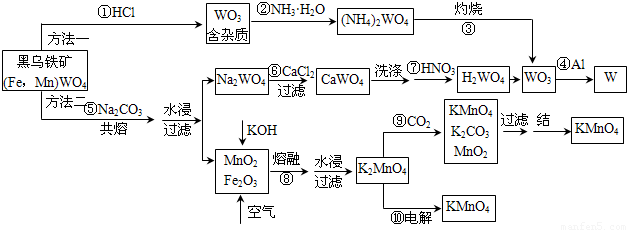
(10分)钨是高熔点金属,工业上用黑钨铁矿[(Fe,Mn)WO4]冶炼金属钨有多种方法,同时还可制得副产品高锰酸钾。已知WO3是钨的稳定氧化物,它不溶于水也不溶于酸,可用钨酸(H2WO4,黄色,不溶于水)或某些钨酸盐分解制得。其主要的工艺流程如下:
请根据图示及所学知识回答下列问题:
(1)写出反应④的化学方程式: ▲ 。
(2)写出反应⑨的离子方程式: ▲ 。
(3)方法二制WO3的过程中,需洗涤CaWO4,如何检验CaWO4已洗涤干净: ▲ 。
(4)整个工艺流程所涉及的物质中,属于酸性氧化物的有 ▲ 。
(5)写出反应⑩中阳极反应的电极反应式: ▲ 。
查看答案和解析>>
科目:高中化学 来源:(教师解析专用)2009~2010学年银川二中高三模拟(二)试题理综化学 题型:填空题
【化学选修2:化学与技术】(15分)
工业上为了使原料和能量得到充分的利用,常常采用循环操作。
I、利用热化学循环制氢能缓解能源矛盾。最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢。MnFe2O4的制备:
已知Fe3+、Mn2+沉淀的pH如右表所示。
| | 开始沉淀 | 完全沉淀 |
| Fe3+ | 2.7 | 4.2 |
| Mn2+ | 8.3 | 10.4 |
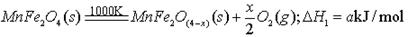
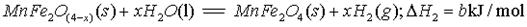
 (填字母编号)。
(填字母编号)。 B.物料可循环使用
B.物料可循环使用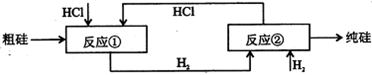
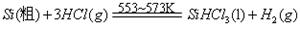
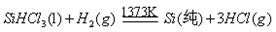
查看答案和解析>>
科目:高中化学 来源:2009-2010学年银川二中高三模拟(二)试题理综化学 题型:填空题
【化学选修2:化学与技术】(15分)
工业上为了使原料和能量得到充分的利用,常常采用循环操作。
I、利用热化学循环制氢能缓解能源矛盾。最近研究发现,复合氧化物铁酸锰(MnFe2O4)可用于热化学循环分解水制氢。MnFe2O4的制备:

已知Fe3+、Mn2+沉淀的pH如右表所示。
|
|
开始沉淀 |
完全沉淀 |
|
Fe3+ |
2.7 |
4.2 |
|
Mn2+ |
8.3 |
10.4 |
(1)此工艺中理论上投入原料Fe(NO3)3和Mn(NO3)2的物质的量之比应为 。
(2)控制pH的操作中m的值为 。
II、用MnFe2O4热化学循环制取氢气:


(3)由上可知,H2燃烧的热化学方程式是 。
(4)该热化学循环制取氢气的优点是 (填字母编号)。
A.过程简单、无污染 B.物料可循环使用
C.氧气和氢气在不同步骤生成,安全且易分离
III、工业上可用H2、HCl通过下图的循环流程制取太阳能材料高纯硅。

反应①
反应②:
(5)上图中,假设在每一轮次的投料生产中,硅元素没有损失,反应①中HCl的利用率和反应②中H2的利用率均为75%。则在下一轮次的生产中,需补充投入HCl和H2的体积比是 。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年江苏省常州市高三上学期期中考试化学 题型:填空题
(10分)钨是高熔点金属,工业上用黑钨铁矿[(Fe,Mn)WO4]冶炼金属钨有多种方法,同时还可制得副产品高锰酸钾。已知WO3是钨的稳定氧化物,它不溶于水也不溶于酸,可用钨酸(H2WO4,黄色,不溶于水)或某些钨酸盐分解制得。其主要的工艺流程如下:
请根据图示及所学知识回答下列问题:
(1)写出反应④的化学方程式: ▲ 。
(2)写出反应⑨的离子方程式: ▲ 。
(3)方法二制WO3的过程中,需洗涤CaWO4,如何检验CaWO4已洗涤干净: ▲ 。
(4)整个工艺流程所涉及的物质中,属于酸性氧化物的有 ▲ 。
(5)写出反应⑩中阳极反应的电极反应式: ▲ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com