
 下图装置可用于收集某气体并验证该气体的某些化学性质,下列选项正确的是( )
下图装置可用于收集某气体并验证该气体的某些化学性质,下列选项正确的是( )| 选项 | 气体 | 试剂 | 现象 | 结论 |
| A | SO2 | 品红溶液 | 溶液褪色 | SO2 有氧化性 |
| B | C2H4 | 溴水 | 溶液褪色 | C2H4能发生加成反应 |
| C | NH3 | 酚酞试液 | 溶液变红 | 氨水具有漂白性 |
| D | Cl2 | 紫色石蕊试液 | 溶液先变红后褪色 | 氯水具有酸性和漂白性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.二氧化硫密度比空气大,可用向上排空法收集,具有漂白性;
B.乙烯不能利用排空气法收集;
C.氨气密度比空气小,不能用向上排空法收集;
D.氯气密度比空气大,可用向上排空法收集,氯水中含盐酸、HClO.
解答 解:A.二氧化硫密度比空气大,可用向上排空法收集,具有漂白性,则品红褪色,与其漂白性有关,与氧化性无关,故A错误;
B.乙烯不能利用排空气法收集,乙烯可与溴水发生加成反应,故B错误;
C.氨气密度比空气小,不能用向上排空法收集,氨水溶液显碱性,故C错误;
D.氯气密度比空气大,可用向上排空法收集,氯水中含盐酸、HClO,则紫色石蕊先变红后褪色,可知氯水具有酸性(H+)和漂白性(HClO),故D正确;
故选D.
点评 本题考查实验方案的评价,为高频考点,侧重于气体的收集和性质检验的考查,注意常见气体的收集方法,把握性质是解答的关键,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 分馏石油时,温度计的水银球必须插入液面以下 | |
| B. | 制备乙酸乙酯时,加料顺序为浓硫酸、乙醇、乙酸 | |
| C. | 配制银氨溶液时,将稀氨水慢慢滴加到稀硝酸银溶液中,产生白色沉淀后继续滴加,直至沉淀刚好溶解为止 | |
| D. | 实验室可用苯和溴水在Fe作催化剂的情况下制备溴苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
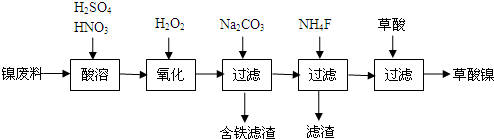
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 22.4LN2中σ键与π键个数比为1:2 | |
| B. | 反应物和生成物中只有氮气属于非电解质 | |
| C. | 该反应每转移1mol电子,有0.2molKNO3被氧化 | |
| D. | NaN3是只含离子键的离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 对粗盐溶液除杂可依次加入NaOH、Na2CO3、BaCl2,再加入盐酸调节溶液pH | |
| B. | 饱和食盐水中先通入的气体为CO2 | |
| C. | 流程图中的系列操作中一定需要玻璃棒 | |
| D. |  如图所示装置可以比较Na2CO3和NaHCO3晶体的热稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器的总压强不随时间而变化 | |
| B. | 容器内气体的密度不再改变 | |
| C. | 单位时间内有nmolA2生成的同时有nmolB2消耗 | |
| D. | v正(A2)=2v逆(AB) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度/℃ | 25 | t1 | t2 |
| 水的离子积常数 | 1×10-14 | α | 1×10-12 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com