
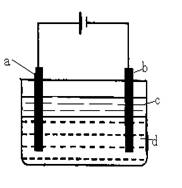
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
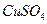 溶液时,通电一段时间后,向所得的溶液中加入0.1mol
溶液时,通电一段时间后,向所得的溶液中加入0.1mol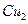 (
(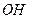 )
)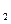
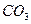 后恰好恢复到点解前的浓度和
后恰好恢复到点解前的浓度和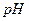 (不考虑二氧化碳的溶解)。则电解过程中转移的电子的物质的量为
(不考虑二氧化碳的溶解)。则电解过程中转移的电子的物质的量为| A.0.4mol | B.0.5mol | C.0.6mol | D.0.8mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.电解池是将化学能转化为电能的装置 |
| B.电解池的阳极发生氧化反应,阴极发生还原反应 |
| C.电解熔融的氯化钠中阴极只能用铁不可用其它电极 |
| D.只可电解熔融的电解质,不能电解电解质溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.阴极只析出H2 | B.阳极先析出Cl2,后析出O2 |
| C.电解最后阶段为电解水 | D.溶液的PH值不断增大,最后为7 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
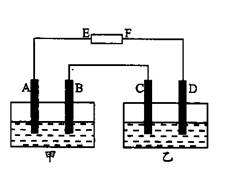
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
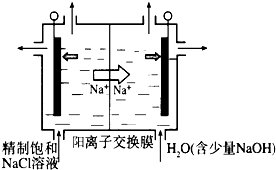
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 阳极 | 阴极 | 溶液甲 | 物质乙 | |
| A | Pt | Pt | NaOH | NaOH固体 |
| B | Pt | Pt | H2SO4 | H2O |
| C | C | Pt | NaCl | 盐酸 |
| D | 粗铜 | 纯铜 | CuSO4 | Cu(OH)2 |
| A.A | B.B | C.C | D.D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com