
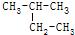 的烃,其正确的命名是( )
的烃,其正确的命名是( )| A. | 1,1-二甲基丙烷 | B. | 2-乙基丙烷 | C. | 3-甲基丁烷 | D. | 2-甲基丁烷 |
 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案科目:高中化学 来源: 题型:解答题
| 实验 次数 | 起始温度t1/℃ | 终止温度 t2/℃ | ||
| H2SO4 | NaOH | 平均值 (保留小数点后一位) | ||
| 1 | 26.3 | 26.0 | 26.1 | 30.1 |
| 2 | 27.0 | 27.3 | 27.2 | 33.3 |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 |
| 4 | 26.5 | 26.2 | 26.3 | 30.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH3CH2CHO与HCHO | B. |  OH与 OH与 CH2OH CH2OH | ||
| C. | 乙酸与HCOOCH3 | D. | CH3CH2Cl与CH3CH2CH2Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为了减缓反应速率可用饱和食盐水代替水进行反应 | |
| B. | 该反应为放热反应 | |
| C. | 生成乙炔的反应为CaC2+H2O→CaO+CH≡CH↑ | |
| D. | 为了除去乙炔气体中的杂质可以用CuSO4溶液洗气 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com