
| A.催化剂是通过降低反应所需的活化能来增大反应速率的 |
| B.对于有气体参加的反应,压强增大,单位体积内的活化分子数增多,发生有效碰撞的机会增多,反应速率加快 |
| C.发生碰撞的分子只要具有足够的能量,就能够发生有效碰撞 |
| D.光、电磁波、超声波等因素会对反应速率产生影响 |
科目:高中化学 来源:不详 题型:单选题
 2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则( )
2C(g)达到平衡时,各物质的物质的量之比为n(A)∶n(B)∶n(C)=2∶2∶1。保持温度不变,以2∶2∶1的物质的量之比再充入A、B、C,则( )查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
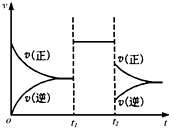
| A.若X是固体,则t1时一定是增大了容器的压强 |
| B.若X是气体,则t2时可能是增大了容器的压强 |
| C.若X是固体,则t1时可能是增大了X的质量 |
| D.t2时不可能是减小容器压强;若采用了降温措施,则该反应的正反应方向△H<0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.t1时,只有正方向反应 |
| B.t2时,X2、Y2、Z2的物质的量相等 |
| C.t2-t3,反应不再发生 |
| D.t2-t3,各物质的浓度不再发生变化 |

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2%H2O2溶液 | 无 |
| ② | 10mL5%H2O2溶液 | 无 |
| ③ | 10mL5%H2O2溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ④ | 10mL5%H2O2溶液+少量HCl溶液 | 1mL0.1mol?L-1FeCl3溶液 |
| ⑤ | 10mL5%H2O2溶液+少量NaOH溶液 | 1mL0.1mol?L-1FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强 |
| B.催化剂不影响反应活化能,从而只影响反应速率,不影响化学平衡 |
| C.向包有Na2O2的脱脂棉吹气后脱脂棉燃烧,说明CO2、H2O与Na2O2反应是放热反应 |
| D.强电解质水溶液的导电性一定大于弱电解质水溶液的导电性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com